FMT150藻类培养与在线监测系统

光养生物反应器是指用于培养藻类、光养细菌等的技术系统,一般由培养系统(如光、培养容器、温度控制等)和监测系统(如PH值等)组成,可分为开放式和封闭式。广泛应用于生物工程领域如食品、水产养殖、营养保健制剂、医药如抗体及抗肿瘤药物等,生态环境工程领域如水体生态修复、CO2吸收、污水处理如重金属吸收等,能源领域如微藻生物柴油等。同时,随着碳排放的增加,海洋藻类对变化的响应也逐渐成为光养生物反应器应用的重要领域。
FMT150藻类培养与在线监测系统将生物反应器与监测仪器独特地结合在一起,用于淡水、海水藻类和蓝细菌(蓝藻)等的模块化精确光照培养与生理监测。
FMT150可以通过控制单元(包括电脑与预装软件,软件分为基本版与版)中用户自定义程序动态自动改变培养条件并实时在线监测培养条件与测量参数。光强、光质、温度和通入气体的组分与流速都可以精确调控。加装恒浊和恒化模块后还可以调控培养基的pH值和浊度。FMT150可连接多达7个蠕动泵进行不同恒化与pH条件培养。培养条件可以根据用户自定义方案动态变化,既可以进行恒定条件下的培养,也可以一定的周期自动变化。控制单元可同时控制多台FMT150进行同步实验,保证不同处理实验间的一致性。
仪器内置叶绿素荧光仪和光密度计等。培养藻类的生长状况由光密度计测定OD680和OD720实现实时监控,并可以通过OD值监测相对叶绿素浓度。叶绿素荧光仪实时监测Ft并可测定F0、Fm、Fm′和QY来反映培养藻类的光合生理状态。
应用领域:
1.环境科学与环境工程——藻类的利用与有害控制
用于水体中水华和赤潮现象的模拟、预警FZ研究,水体污染治理与生态修复研究如利用藻类进行水体重金属污染及面源污染的消纳研究等,大气污染生态修复研究如利用藻类对污染排放进行吸收的研究等,及利用藻类吸收大气二氧化碳的研究等等。
2.生态学与生态工程
海洋初级生产力研究,海洋碳循环,浮游植物等光养生物生理生态研究,藻类对变化的响应机制,生态毒理学研究,生物圈模拟研究,水体生态修复研究等。

3.藻类基因组学与分子生物学
为分子、基因实验提供可靠的预培养样品,精确模拟培养条件,研究不同环境条件下藻类表型变化
4.生物工程与生物医学工程
用于藻类保健营养品的开发研究,藻类转基因抗肿瘤药物的开发研究,水产养殖藻类培养等等。
5.生物能源开发——向藻类要能源
地球上的石油、煤炭等常规能源面临资源枯竭及环境污染、温室气体排放等严重问题,用玉米等粮食进行生物柴油的开发一度引起的粮食危机,目前国际上已将生物柴油的开发焦点转向藻类,藻类独居植物产油率榜首。FMT150已成为欧美用于藻类生物能源培养研究的热门设备。
主要特点:
·国际将藻类光生物反应器技术与藻类生理监测技术(叶绿素荧光技术、光密度测量)结合起来的系统,集成了目前几乎所有主要的藻类在线培养与生理监测技术
·内置双调制叶绿素荧光仪,实时监测培养藻类的生理状况,测量记录荧光参数Ft,Fm,QY等
·内置光密度计,测量OD680和OD720,经过校准可计算生物量(藻类细胞数量)、叶绿素浓度
·配备气泡阻断阀和气泡加湿器,使荧光和OD值的测定更加精确
·可同时测量监测温度、pH值、溶解氧等多种参数
·精确控制温度、光质、光强、培养周期等,并可进行恒化或恒浊培养
·培养容器使用高强度耐热耐腐蚀材料,可进行高温灭菌
·光化学光强度ZG达3000 umol photons m-2 s-1(蓝绿藻培养正常光强为90 umol photons m-2 s-1),可升级达3000 umol photons m-2 s-1,光质可根据用户需求在红光、蓝光、白光中选择单色光或双色光,扩展光源中还可以加入红外光
·气流速率、CO2及O2浓度可精确控制
·可通过专用的电脑软件实现外部控制、数据监测和保存,操作简单
技术参数指标
1.测量参数:
1)叶绿素荧光参数:暗适应条件下F0, Fm, Fv(Fm-F0), QY(Fv/Fm),光适应条件下Ft, Fm‘, Fv‘(Fm‘-Ft), QY(ΦPSII即量子产额)
2)光密度:OD680、OD720
3)环境参数:温度、光照强度、pH、溶解氧(选配)、溶解CO2(选配)
2.调控环境参数:温度、光强、通气速度、通入气体组分与含量(需选配GMS高精度气体混合系统)、恒化(恒定pH)培养与恒浊(恒定OD)培养(需选配相应模块),所有参数都可以单独同步控制。
3.容积:400 ml/1000 ml/3000ml可选
4.温度精确控制范围:400 ml/1000 ml标准培养容器18 - 55℃,3000ml标准培养容器18 - 55℃, 400 ml增强培养容器5 - 75℃,1000 ml/3000 ml增强培养容器10 - 75℃(实际控温效果与环境温度有关)
5.控温系统:2个珀耳帖元件(200W,400W)
6.双显示:主机控制显示和外部控制单元实时显示
7.LED光源:
标准配制:红光、蓝光或白光、红光双色光源,可选白光、蓝光双色光源或白、蓝、红单色光源
光强:1500 umol (photons).m-2.s-1 PAR(蓝光750/红光750;白光750/红光750;可选白光1500,蓝光1500,红光1500,白光750/蓝光750)
可升级3000 umol (photons).m-2.s-1 PAR(蓝光1500/红光1500;白光1500/红光1500;白光或蓝光单色3000)
8.外部扩展光源(备选,用于不同有机体培养或者高光强胁迫):单色光、单色光+红外光、双色光
9.光密度测量:通过两个LED (720nm,680 nm)实时测量OD
10.检测器:PIN光敏二极管、665 nm-750nm滤波器
11.传感器:pH/温度传感器、溶解氧传感器(备选)、溶解CO2传感器(备选)
12.GMS高精度气体混合系统(备选):可控制气体流速和成分,标配为控制氮气/空气和二氧化碳,气源需用户自备
13.选配Oxzala 差分式O2/CO2通量监测系统,在线双通道监测进气口和出气口O2和CO2:
a)高精度差分式氧气分析仪,双燃料电池技术,双通道差分测量,测量范围0-100%,精确度0.1%,分辨率0.0001%;温度补偿、气压补偿,气压分辨率0.0001kPa,显示屏同时显示通道1O2浓度、通道2O2浓度、通道3ΔO2、通道4气压
b)双通道CO2分析仪,单光束双波长红外技术,测量范围0-1000ppm,可选配0-2000ppm,精确度优于1.5%,差分测量可达0.3-0.5ppm,自动温度补偿、自定义压力及相对湿度补偿,分辨率1ppm,双通道数据采集显示器,LCD背光显示屏,可显示双通道CO2浓度及变化曲线
14.恒浊培养模块(可选):包含一个蠕动泵pp600和内置支持控制软件,通过检测光密度(OD680或OD720),蠕动泵自动补充培养基实现恒浊培养
15.恒化培养模块(可选):包含2个蠕动泵pp600和内置支持控制软件,通过检测pH,2个蠕动泵分别自动补充酸液或碱液实现恒化培养
16.pH稳定/恒浊模块(可选):包含1个带气体阀的蠕动泵pp600和内置支持控制软件,可以进行恒浊培养,也可以通过调节通入培养基的CO2气流流速来实现pH稳定调控(两个功能不可同时实现)。CO2气源需用户自备
17.额外蠕动泵(可选):多可同时控制8个蠕动泵
18.其他备选部件:磁力搅拌器(用于无氧状态培养)、气体分析系统(测定CO2)、PWM泵(用于控制气体或液体流速,可以为培养液通气,也可用于无氧状态下代替磁力搅拌混匀藻液)
19.控制单元:包括专用电脑、软件及硬件绑定的许可证,对一到多台反应器进行同步控制和数据采集,所有测量数据都可以实时图形化显示
20.软件功能:
基础版 | 版 |
l 可同时控制2台FMT150主机 l 在线软件升级 l 附件(如pH电极)校准 l 修改实验培养程序 l 电脑重启后恢复实验 l 记录传感器原始数据 l 记录用户/系统实验事件 l 导出实验数据到Excel l 实验记录过滤 l 用户及权限管理 l 支持OD调控(恒浊)程序 l 支持pH调控(恒化)程序 l 支持外部扩展光源调控程序 l 支持PWM泵或磁力搅拌程序 l Ft/QY测量 | l 可同时控制数量不限的FMT150主机 l 包含基础版所有功能 l Email通知 l 允许发送低级设备命令 l 支持修改程序脚本 l 可在程序内设置单独的测量周期 l 导入以前的实验 l 预订实验计划 l 监测并通知附件(如pH电极)值域 l 用户自定义实验图数据系列 l 实验图数据回归分析 l 支持气体分析系统 l 支持气体混合系统 l 控制额外的蠕动泵 |
|
|
21.控光模式:光质和光强均可通过软件按用户编制的程序自行动态变化,可模拟自然日照周期、云遮挡造成的光强光质变化等光节律变化
22.控温模式:温度可通过软件按用户编制的程序自行动态变化,可模拟自然温度日变化、温度周期性骤升或骤降等
23.Bios:可升级固件
24.数据传输:RS-232串口接口或USB接口
25.远程控制:可通过网络实现远程控制与数据下载(需配备固定IP)
26.材料:防火耐热玻璃、飞机专用杜拉铝合金、不锈钢、硅化垫圈
27.尺寸:400ml,42 cm(H)×35 cm(W)×31 cm(D),重量:15.5kg;1000ml,42 cm(H)×35 cm(W)×31 cm(D),重量:17.5kg;3000ml,50 cm(H)×35 cm(W)×31 cm(D),重量:28kg
28.供电电压:90-240V
29.可根据用户需求定制25升等各种大型光养生物反应器
应用案例:
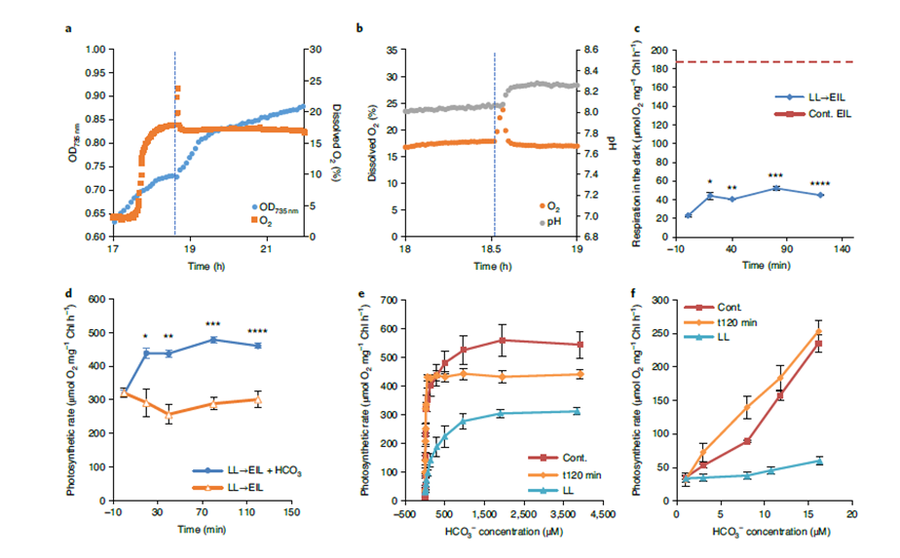
沙漠绿藻多组学解析的精确培养条件模拟及实时在线监测(Treves, 2020, Nature Plants)
产地:欧洲
参考文献:
1. Adriana R, et al. 2023. Microalgae adaptation as a strategy to recycle the aqueous phase from hydrothermal liquefaction. Bioresource Technology 371: 128631.
2. Masuda T, et al. 2023. The balance between photosynthesis and respiration explains the niche differentiation between Crocosphaera and Cyanothece. Computational and Structural Biotechnology Journal 21: 58-65.
3. Mattoon EM, et al. 2023. High‐throughput identification of novel heat tolerance genes via genome‐wide pooled mutant screens in the model green alga Chlamydomonas reinhardtii. Plant, Cell & Environment 46(3): 865-888.
4. Treves H, et al. 2022. Carbon flux through photosynthesis and central carbon metabolism show distinct patterns between algae, C3 and C4 plants. Nature Plants 8: 78–91.
5. Ozawa SI, et al. 2022. Algal PETC-Pro171-Leu suppresses electron transfer in cytochrome b6f under acidic lumenal conditions. Plant Physiology. Doi: 10.1093/plphys/kiac575.
6. Trivedi J, et al. 2022. Enhanced lipid production in Scenedesmus obliquus via nitrogen starvation in a two-stage cultivation process andevaluation for biodiesel production. Fuel 316: 123418.
7. Park H, et al. 2022. Co-production of biofuel, bioplastics and biochemicals during extended fermentation of Halomonas bluephagenesis. Microbial biotechnology 16(2): 307-321.
8. Zhang N, et al. 2022. Systems-wide analysis revealed shared and unique responses to moderate and acute high temperatures in the green alga Chlamydomonas reinhardtii. Commun Biol 5: 460.
9. Zhang HR, et al. 2022. The DIC carbon isotope evolutions during CO2 bubbling: implications for ocean acidification laboratory culture. Frontiers in Marine Science 9: 2603.
10. Zaki A, et al. 2022. Synthesis, purification and characterization of Plectonema derived AgNPs with elucidation of the role of protein in nanoparticle stabilization. RSC Advances 12(4): 2497-2510.
11. Harth FM, et al. 2022. Ru/C‐Catalyzed Hydrogenation of Aqueous Glycolic Acid from Microalgae–Influence of pH and Biologically Relevant Additives. ChemistryOpen 11(7): e202200050.
12. MATTILA H, et al. 2022. Differences in susceptibility to photoinhibition do not determine growth rate under moderate light in batch or turbidostat – a study with five green algae. PHOTOSYNTHETICA 60 (1): 10-20.
13. Vasile NS, et al. 2021. Computational analysis of dynamic light exposure of unicellular algal cells in a flat-panel photobioreactor to support light-induced CO2 bioprocess development. Frontiers in microbiology 12: 639482.
14. Rabouille S, et al. 2021. Electron & Biomass Dynamics of Cyanothece Under Interacting Nitrogen & Carbon Limitations. Frontiers in Microbiology 12: 620.
15. Polerecky L, et al. 2021. Temporal Patterns and Intra-and Inter-Cellular Variability in Carbon and Nitrogen Assimilation by the Unicellular Cyanobacterium Cyanothece sp. ATCC 51142. Frontiers in Microbiology 12: 620915.
16. Lang I, et al. 2021. Plasticity of the Red Alga Dixoniella grisea for the Production of Additives for Lubricants. Plants 10(9): 1836.
17. Kedem I, et al. 2021. Juggling Lightning: How Chlorella ohadii handles extreme energy inputs without damage. Photosynthesis Research 6: 1-16.
18. Norsker NH, et al. 2021. Developing microalgal oil production for an outdoor photobioreactor. Journal of Applied Phycology. doi: 10.1007/S10811-021-02374-7.
19. Klein BC, et al. 2021. Effect of light, CO2 and nitrate concentration on Chlorella vulgaris growth and composition in a flat-plate photobioreactor. Brazilian Journal of Chemical Engineering 38(2): 251–263.
20. Amer M, et al. 2020. Low Carbon Strategies for Sustainable Bio-alkane Gas Production and Renewable Energy. Energy & Environmental Science 13(6): 1818-1831.
21. Kanygin A, et al. 2020. Rewiring photosynthesis: a photosystem I-hydrogenase chimera that makes H2 in vivo. Energy & Environmental Science 13: 2903-2914.
22. Treves H, et al. 2020. Multi-omics reveals mechanisms of total resistance to extreme illumination of a desert alga. Nature Plants 6(8): 1031-1043..
23. Klassen V, et al. 2020. Wastewater-borne microalga Chlamydomonas sp.: A robust chassis for efficient biomass and biomethane production applying low-N cultivation strategy. Bioresource Technology 315: 123825.
24. Canonico M, et al. 2020. Plasticity of Cyanobacterial Thylakoid Microdomains Under Variable Light Conditions. Frontiers in Plant Science 11:586543.
25. Baránková B, et al. 2020. Light absorption and scattering by high light-tolerant, fast-growing Chlorella vulgaris IPPAS C-1 cells. Algal Research 49: 2211-9264.
北京易科泰生态技术有限公司
仪器网(yiqi.com)--仪器行业网络宣传传媒