藻类表型研究全面解决方案
藻类是蓝藻门、眼虫藻门、金藻门、甲藻门、绿藻门、褐藻门、红藻门等一系列水生生物的总称。其形态种类众多,小微米级的单细胞微藻,大长达几米乃几十米的大型褐藻。藻类作为水体中重要的初级生产者,对整个生态系统乃地球圈的稳定都起着极为重要的作用。莱茵衣藻、蓝藻等模式藻类为功能基因、生物进化、光合作用等研究提供了JJ的材料。同时,很多经济藻类也在食品、医药、能源等行业中扮演重要角色。而水华、赤潮等有害生态现象也是由藻类造成的。因此,对藻类的研究一直是生物学和生态学中非常重要的热点
目前生命科学研究领域为引人注目的研究热点之一——表型组学研究,还主要集中在植物/作物领域。在藻类领域,表型组学研究刚刚起步,但发展速度极为迅猛。藻类表型组学一方面是藻类基因组学的补充与验证,解释基因组和环境因素对植物表型的复杂作用及中间的变化过程;另一方面可以用于经济藻类的抗逆生理研究和遗传育种,全面分析藻类表型,获取更优良的经济藻种;还可以用于水华、赤潮的发生机理研究。
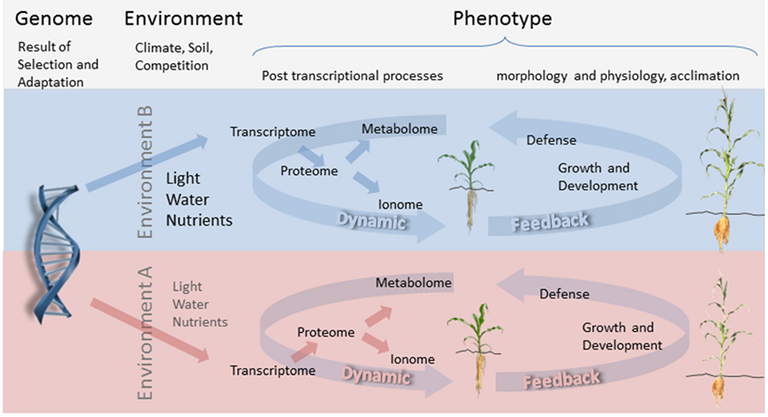
藻类表型组学需要全面分析藻类的表型特征,尤其是光合生理、形态、颜色、色素组成与分布、不同色素的光合贡献、胁迫生理等方面的测量与分析,使藻类表型数字化、生理生态及功能可视化。这就需要针对藻类表型专门设计的技术解决方案。
按表型数据类型分类: | |
藻类培养与常规生理表型数据在线监测仪器 | l FMT150藻类培养与在线监测系统 l MC1000 8通道藻类培养系统 l ET-PSI多功能藻类培养与在线监测系统 l AlgaeTron/FytoScope 藻类培养箱 |
光合作用表型 | l AquaPen手持式藻类荧光测量仪 l Monitoring Pen叶绿素荧光自动监测仪 l FluorCam系列叶绿素荧光成像系统 l FluorCam多光谱荧光成像系统 l FKM多光谱荧光动态显微成像系统 l FL6000双调制叶绿素荧光仪 l TL6000叶绿素热释光测量系统 l AOM藻类荧光在线监测系统 l PlanTherm植物/藻类热耐受性测量仪 |
光谱表型 | l PolyPen Aqua PA210试管式高光谱测量仪 l Specim-IQ手持式高光谱成像仪 |
高通量综合表型分析 | l 高通量藻类表型分析系统 |
按使用方式分类: | |
监测式仪器 | l Monitoring Pen叶绿素荧光自动监测仪 l AOM藻类荧光在线监测系统 |
便携式仪器 | l AquaPen手持式藻类荧光测量仪 l PolyPen Aqua PA210试管式高光谱测量仪 l Specim-IQ手持式高光谱成像仪 l FluorCam便携式叶绿素荧光成像仪 |
实验室仪器 | l FMT150藻类培养与在线监测系统 l MC1000 8通道藻类培养系统 l ET-PSI多功能藻类培养与在线监测系统 l AlgaeTron 藻类培养箱 l FluorCam系列叶绿素荧光成像系统(除便携式) l FluorCam多光谱荧光成像系统 l FKM多光谱荧光动态显微成像系统 l FL6000双调制叶绿素荧光仪 l TL6000叶绿素热释光测量系统 l PlanTherm植物/藻类热耐受性测量仪 |
高通量自动测量系统 | l 高通量藻类表型分析系统 |
方案中所列举的仪器可以根据具体研究需求灵活组合,而且所有仪器的国际认可度极高,国内外科学家均使用这些仪器发表了大量科研论文。下面介绍部分系统方案的应用案例。
1. 蓝藻光合作用机理的深入研究
中科院水生生物所王强研究员为了研究亚硝酸盐胁迫对蓝藻Synechocystis sp. PCC 6803光系统II的胁迫机制,使用AquaPen手持式藻类荧光测量仪、FL3500叶绿素荧光仪(FL6000之前型号)和TL叶绿素热释光系统,分别测量分析了Fv/FmZD光化学效率、OJIP快速荧光动力学曲线、QA-再氧化动力学曲线、S-state测量和TL热释光曲线。研究ZZ证明亚硝酸盐胁迫首先影响Synechocystis sp. PCC 6803 光系统II受体侧(Zhan X, 2017)
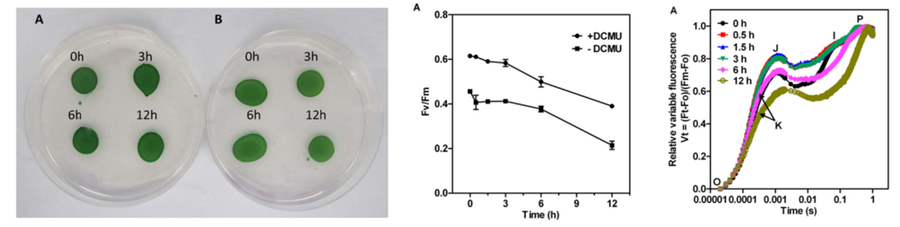
左:实验样品;中:Fv/Fm;右:OJIP快速荧光动力学曲线
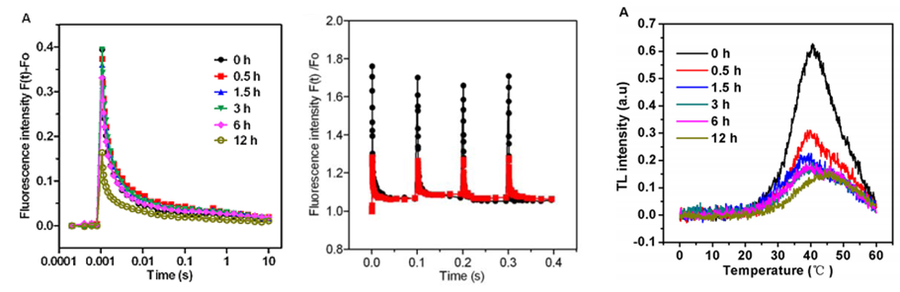
左:QA-再氧化动力学曲线;中:S-state测量:右:TL热释光曲线

左:AquaPen手持式藻类荧光测量仪;中:FL3500双调制叶绿素荧光仪;右:TL叶绿素热释光系统
参考文献:Zhang X, Ma F, Zhu X, Zhu J, Rong J, Zhan J, Chen H, He C, Wang Q. 2017. The acceptor side of photosystem II is the initial target of nitrite stress in Synechocystis sp. strain PCC 6803. Appl Environ Microbiol 83:e02952-16
2. 莱茵衣藻分子事件的多组学解析
莱茵衣藻Chlamydomonas reinhardtii的新陈代谢对环境变化有很好的适应性。加利福尼亚大学的Daniela Strenkert尝试模拟一个光暗周期,研究这中莱茵衣藻的转录组与蛋白质组变化。这一研究首先要求能够精确模拟一个动态变化的培养环境,同时还要对相关培养环境及藻类密度、生理等进行监测。这样才能为后续的组学分析提供尽量JZ的样品。而目前能达到这一要求的藻类培养监测仪器只有FMT150藻类培养与在线监测系统。其培养条件设置如下:
n 多台FMT150同步培养
n 200 μE红/蓝光,12小时昼夜交替,模拟日升日落
n 白天28 ℃,夜晚18 ℃
n 通气速度0.2 L/min
n 实时监测温度、OD680和pH
恒浊预培养5天,控制OD6800.4
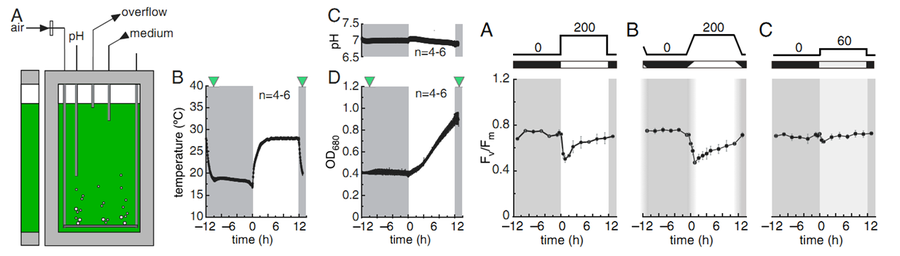
左:A.FMT150示意图,B-D.培养过程中实时监测温度、OD680和pH;右:不同光强下ZD光化学效率Fv/Fm的动态变化
叶绿素荧光分析是光合生理和表型组学研究不可或缺的部分。因此本研究同时使用FluorCam封闭式荧光成像系统测量不同光强下莱茵衣藻ZD光化学效率Fv/Fm的动态变化,反映光强对莱茵衣藻的影响并与蛋白质组、转录组数据进行相关分析

左:FMT150藻类培养与在线监测系统;右:FluorCam封闭式叶绿素荧光成像系统
参考文献:Strenkert D, et al. 2019, Multiomics resolution of molecular events during a day in the life of Chlamydomonas. PNAS 116 (6): 2374-2383
3. 监测南极藻类与地衣的气候响应
2006年,捷克在南极James Ross岛建设了Johann Gregor Mendel站。驻扎该站的捷克马萨里克大学科研人员从2007年就开展研究当地藻类和地衣对南极温度升高的响应,从而评估温室效应对南极生态系统的影响。当时他们使用了专门加强极地适应能力的AquaPen/FluorPen系列手持式叶绿素荧光测量仪来检测藻类和地衣的光合生理和生长状态。AquaPen/FluorPen既可以手动操作,也具备无人值守监测叶绿素荧光的功能,在南极的严酷环境下表现良好。
而近年,科研人员开始使用专门设计用于监测实验的Monitoring Pen叶绿素荧光自动监测仪。Monitoring Pen在理想情况下可自动连续工作2年,配有陆地增强版和水下增强版两个版本。

左:Johann Gregor Mendel站2007-2009年使用的AquaPen/FluorPen;右:近年开始使用的Monitoring Pen

左:Monitoring Pen陆地增强版;右:Monitoring Pen水下增强版
参考文献:Barták M, et al. 2009, Long-term study on vegetation responses to manipulated warming using open top chambers installed in three contrasting Antarctic habitats. Structure and function of antarctic terrestrial ecosystems, Masaryk University
4. 莱茵衣藻高光胁迫响应的分子机制
所有光合生物都必须要应对过量光照来避免光合氧化胁迫。对于植物和绿藻来说,高光的快响应机制就是光系统II的非光化学淬灭(NPQ)。这一过程允许光系统II将过量能量以热量形式安全地耗散掉。PsbS蛋白是这一过程中的重要传感器。
为了确定PsbS蛋白在莱茵衣藻Chlamydomonas reinhardtii的NPQ和光保护中的作用,艾克斯-马赛大学Tibiletti T等培养了可以表达藻类或拟南芥psbS基因的叶绿体转基因株。通过FluorCam开放式叶绿素荧光成像系统进行的NPQ成像分析ZZ表明,两种PsbS蛋白都可以增强莱茵衣藻野生型和npq4突变株的NPQ,但通过Fv/Fm测量没有观察到明确的光保护活性。
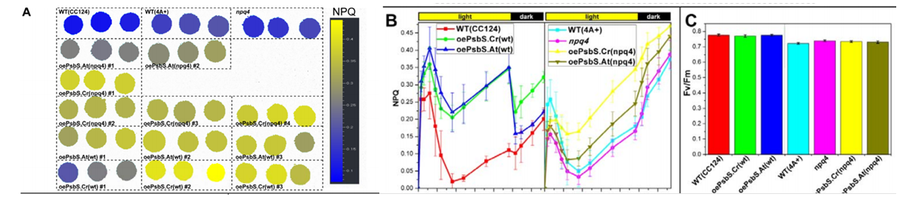
左:NPQ成像图;中:光暗周期中的NPQ动态变化;右:Fv/Fm数据分析
同时,他们还使用了两个白光LED光源板来模拟持续高光胁迫(1200 µmol m-2 s-1);Fytoled光源系统来模拟波动光照条件(3分钟1200µmol m-2 s-1+3分钟45µmol m-2 s-1)进行生长率实验;FluorCam系统自带蓝色LED光源板模拟波动光照条件(3分钟1200µmol m-2 s-1+3分钟20µmol m-2 s-1)进行Fv/Fm分析。这些LED光源板实际都来自于同一技术来源,即PSI公司的SL3500 LED光源板。这一LED光源的开发就是为了给FluorCam系统测量叶绿素荧光成像提供高强度、高均一度、高纯度的光照,同时配备精确到微秒级的自动调控功能。以此LED光源为基础开发的培养系统自然就具备了其他培养系统无法达到的高性能。欧美很多研究者都会使用这一光源搭建自己设计的培养系统。比如2012年Nature发表的“Recovery rates reflect distance to a tipping point in a living system”一文中,作者就使用了SL3500光源搭建了自主设计的藻类培养系统。

左:FluorCam开放式叶绿素荧光成像系统;中:SL3500 LED光源板;右:AlgaeTron/FytoScope藻类/植物培养箱
参考文献:Tibiletti T, et al. 2016. Chlamydomonas reinhardtii PsbS protein is functional and accumulates rapidly and transiently under high light. Plant Physiology, 171(4): 2717-2730
北京易科泰生态技术有限公司
仪器网(yiqi.com)--仪器行业网络宣传传媒