蛋白质纯化方法经典攻略(二)
2022-03-10798那么下面上海嘉鹏科技有限公司为大家简单介绍一下关于蛋白质纯化方法经典攻略(二):
初始样品制备
无论目标蛋白的来源如何,作为纯化的初始步骤,原始样品的制备很重要。同时也需要考虑表达和纯化策略。
目标蛋白的胞外分泌可使用简单快速亲和纯化方案;所需的唯*一样品制备可能需要倾倒贴壁细胞的条件培养基或者低速离心以去除悬浮细胞。当然,制备过程的**步色谱层析时可能需要加入蛋白酶抑 制剂或者调节pH,但这些步骤简单易行。然而,如果**步纯化样品步骤进行离子交换,样品则可能需要首先脱盐。当处理大量条件培养基时可能会有技术难度;根据培养基的脱盐体积常可采用透析或错流过滤。
如果靶蛋白在胞内表达,则细胞首先需要通过离心获取,然后用合适的裂解缓冲液重悬。如上所述,裂解缓冲液需要包含合适的缓冲液和其它添加剂以确保靶蛋白的*大稳定性。如果研究者在柱层析之前避免耗时的缓冲液交换步骤,则样品/裂解缓冲液的组成也需与随后的纯化步骤相适宜。
接下来,需要有效的细胞裂解方法。大肠杆菌可以通过弗氏压碎器裂解(尽管这种方法不容易规模化),超声或基于洗涤剂的裂解(有很多商业裂解试剂)。通过向裂解缓冲液中加入溶菌酶可以改善基于洗涤剂的裂解效率。基于洗涤剂的裂解非常温和,且不导致细*菌DNA的显着切变。因此,为了降低样品粘度产生具有良好流动特性的样品,通常需要加入含DNA酶(高纯度制剂可商购)。
哺乳动物和昆虫细胞也可以通过超声或基于洗涤剂的方法裂解。如果核膜显着裂解,可能需要DNA酶处理降低样品粘度。
一旦细胞(微生物/昆虫/哺乳动物)被裂解,通常需要离心除去细胞碎片(通常在4℃下15000×g离心15分钟,以避免色谱柱堵塞)。所得上清液即可开始用于靶蛋白的柱色谱层析纯化。
柱层析设备柱层析的基本原理是将一份蛋白质混合物分成很多小份,从而使某些组分中目标蛋白的浓度通过浓缩得以增大。虽然已经有很多昂贵和特殊的设备可用于柱层析,但实际上它只需要*基本的设备即可。
基本柱层析设备1、固定相:一种惰性介质, 通常带有一种可促进蛋白质相互作用的官能团以进行蛋白质分离。固定相和官能团的选择取决于层析色谱和方法的种类。
2、柱子:一种圆柱形玻璃容器,长度和直径各不相同。柱子可以直接购买已填装固定相能直接连接到层析设备上使用的预装柱,或可购买空柱自己手动填装。自动层析设备和人工重力柱使用的是不种类型的柱子。
3、溶剂:含有添加剂的缓冲液,作为将蛋白质在固定相上平衡和洗脱的流动相。不同类型的柱层析需要不同的溶液条件。
4、收集管:用于收集洗脱液样品的容器。自动组分收集器需要特定的收集管。手动收集时,则试管或容器均可使用。
5、纯度检测方法:一种检测样品里所有蛋白质中目标蛋白相对含量的检测手段。每一步获得的含有目标蛋白的组分都必须在进行下一步纯化工作前进行检测。后面的章节将对一些常用的纯度分析方法进行讨论。
层析系统柱层析可以依赖用泵将溶剂以固定流速打入填装好的层析柱的自动设备来完成或者依靠流动相的重力作用自己完成。自动系统或者重力柱系统均可与自动组分收集器连接使用。
| 系统类型 | 优点 | 缺点 |
| 自动 |
| 需要配套特定、昂贵的设备*大流速受层析柱压力限限制 |
| 重力流 |
| 更依赖人工流速受重力作用限制 |
表三:蛋白质分离柱层析系统亲和层析亲和层析主要依靠蛋白质与介质配体间特异性的可逆结合作用进行分离。配体可直接与目标蛋白质结合,也可以与蛋白质共价结合的标签结合。亲和层析通常是一种*粗放的纯化过程,一般在纯化工艺的前期应用。基于后续应用的要求,可能只需要一步亲和层析即可获得纯度合格的蛋白质。
亲和层析的固定相是一种共价结合特异性配体的惰性介质,该配体可与一个蛋白质或一类蛋白质特异性结合。惰性介质通常是交联的琼脂糖或者聚丙烯酰胺。蛋白质可采用选择性或非选择性模式来进行亲和柱层析纯化。在选择性亲和柱层析中,一般使用对蛋白质有特异性作用的配体或共价结合的标签。在非选择性亲和柱层析中,如用于免*疫球蛋白纯化的蛋白A、G、L,用于DNA结合蛋白的肝素或用于糖蛋白的凝集素等,这些配体与一类蛋白都具有相似的结合能力。
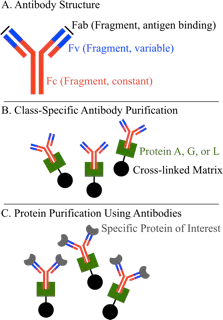
图 4. 用蛋白A、G、L进行亲和层析的原理示意图:A.抗体含有多个功能区:一类蛋白质的Fc区(片段,恒定区) 都是相同的,Fv区(片段,可变区)是每个抗体各不相同的特异区,Fab(片段,抗原区)是抗体实际与特异性抗原结合的区域。B.抗体的特异性区域可以通过亲和色谱进行非选择性纯化,在该过程中,配体 (蛋白 A、G、L)是结合在分离介质上的。C. 蛋白A、G、L亦可用于纯化特异性蛋白。这种情况下,抗体作为中间配体为其抗原提供选择性。
两类亲和色谱中,在不影响蛋白质(或标签) 和配体间作用力的条件下,蛋白质均在柱上保留。在不破坏特异性相互作用但可破坏所有杂蛋白与固定相间其非特异性作用的条件下,对所有结合的蛋白质进行淋洗。*后用含有竞争分子的缓冲液或者可破坏所有蛋白质间相互作用的条件对结合蛋白进行洗脱。
竞争分子可代替目标蛋白与配体相结合。这种竞争分子可通过其他层析手段或者透析的方式从目标蛋白中去除。通过破坏所有蛋白间相互作用来从固定相洗脱蛋白的方法包括调节缓冲液的pH值或者离子强度。因为这些方法同样会影响蛋白质的稳定性,因此通常建议洗脱下来的蛋白质要立即中和或者稀释以将危害降到*小。有报道称,对于不同形式的亲和层析,为获得*高产率的活性蛋白需采用多种不同的流动相条件 。
| 目标蛋白 | 配体伴随 | 洗脱 |
| 抗体(抗原特异性) | 抗原多肽 | 自由肽 |
| 多组氨酸标记蛋白 | Ni2+ or Co2+ | 咪唑或游离组氨酸 |
| FLAG标记蛋白质 | FLAG特异性抗体 | FLAG多肽或低pH值 |
| GST标记蛋白质 | 还原型谷胱甘肽 | 游离谷胱甘肽 |
| Myc标记蛋白质 | Myc特异性抗体 | 低pH值 |
| 抗体(类型特异性) | 蛋白A , G, or L | 极端pH值 |
| DNA结合蛋白质 | 肝素 | 高离子强度 |
表五:带有特异性活性官能团(配体)的选择性和非选择性亲和层析示例及其典型洗脱条件。总结自Thermo Fisher Pierce和GE。不同类型层析柱的供应商见下,由来邦网(Labome)基于200余篇文献调研给出。
设计蛋白质表达质粒时,即可在其N端或C端(或在少数情况下,在结构已知蛋白质的柔性环状区域) 引入亲和标签以助于纯化。
抗体通常是基于抗体与其抗原 (抗体识别的序列) 间的高特异性相互作用来进行纯化。一个含有抗原的多肽可以与带有抗体特异结合位点的介质相结合。降低流动相缓冲液的pH值可破坏抗体/多肽间相互作用力,释放出结合抗体。商业上,该方法常用于血清原液中抗体的纯化。
蛋白质同样可通过非选择性方式进行亲和纯化。在非选择性纯化过程中,固定相上结合的配体可以与一类具有类似结合部位的蛋白质相结合。DNA结合蛋白质的纯化就是一个非选择性亲和层析的实例。因为肝素与DNA的结构和电荷极为类似,它可以被作为DNA结合蛋白质亲和层析的配体。
由于所有的DNA结合蛋白质理论上都可以与该固定相结合,几乎其他所有蛋白质都会穿透而不与介质结合,从而可达到目标蛋白产率*大程度的富集。另一个例子是抗体通过其恒定区 (Fc)与配体间的相互作用进行富集浓缩,蛋白A、G、L都是常用的配体。GE Healthcare的蛋白A亲和层析柱 [15-17] 和蛋白G [18] 都是常用的选择。
当采用类似的结合模式(抗体与蛋白A、 G或 L配体结合)时,抗体的抗原结合区(Fab)仍然保持与其特异性抗原结合的能力。因此,特异性蛋白可通过配体/抗体结合和抗体的抗原间的特异性相互作用来纯化。
常见问题及解决方式见表6。
| 问题 | 原因 | 解决方法 |
| 蛋白不结合 | 标签未翻译或不可及 | 检查质粒序列或将标签移到其他位置 |
| 结合条件不合适 | 调节缓冲液条件 | |
| 结合时间不够 | 降低流速或停止过柱以延长结合时间 | |
| 蛋白未洗脱出 | 配体与标签间相互作用过强 | 增大(特异性) 竞争分子浓度或调节条件更严格(非特异性) |
| 蛋白质柱上聚集 | 调整缓冲液到更利于保持蛋白质稳定性的条件 | |
| 低分辨率 | 流速过慢或过快 | 调整流速 |
| 柱子未充分洗脱 | 用条件更严格的缓冲液淋洗;根据厂家指导清洗固定相 | |
| 蛋白质柱上聚集 | 调整缓冲液到更利于保持蛋白质稳定性的条件 | |
| 洗脱条件不够严格 | 增大(特异性) 竞争分子浓度,或调节条件(非特异性) | |
| 纯化过程中蛋白质失活 | 蛋白质去折叠或聚集 | 调整缓冲液到更利于保持蛋白质稳定性的条件 |
| 保持活性必要的辅因子在纯化过程中被除去 | 添加辅因子 |
以上就是上海嘉鹏科技有限公司为大家整理总结蛋白质纯化方法经典攻略(二)。
我们上海嘉鹏科技有限公司是专业生产超蛋白纯化系统、超微量核酸蛋白测定仪、化学发光成像系统、凝胶成像分析系统、紫外分析仪、核酸蛋白检测仪、紫外检测仪、光化学反应仪、旋涡混合器、恒流泵、自动部分收集器等为核心的十几个产品系列的厂家,欢迎大家前来订购
-
- 蛋白纯化系统JP-blupadStar
- 品牌:嘉鹏
- 型号:JP-blupadStar


