| 行业应用: | 仪器仪表 仪器仪表 |
因生物制品多是使用非人源的连续传代菌株或细胞株来表达生产,即使经过严格的纯化工艺仍然容易在成品中残留宿主细胞的DNA片段。宿主残留DNA会带来各种不可控的潜在风险。因此,残留DNA的含量不仅是产品质量的一个重要指标,更是与安全性密切相关。宿主DNA残留量是生物制品各质量控制标准的重中之重。
宿主残留DNA风险
致瘤性
宿主细胞基因组序列可能插入人体染色体,激活原癌基因(如Ras癌基因)或抑 制抑癌基因。
传染性
宿主细胞DNA中可能存在病毒(如HIV病毒)基因组,整合到人体基因组能够扩增产生传染性病毒粒子。
免疫源性
微生物来源的基因组DNA富含CpG和非甲基化序列,可能增加免疫反应诱导产生DNA抗体。
宿主残留DNA标准
WHO、FDA、EMA及我国的NMPA等监管机构对生物制品成品的宿主DNA残留量都有严格的限制,其在生产过程中的清除情况是监管的重要内容。

宿主残留DNA检测方法
各国药典提供了数种宿主DNA残留量的检测方法,主要包括杂交探针法、阈值法、荧光染料法和qPCR法。随着法规要求的日趋严格,杂交探针法、阈值法和荧光染料法已不能满足产品质量控制的要求,正逐步被发达国家药典淘汰。qPCR法具有特异性强、灵敏度高、重复性好,能够实现快速定量检测的技术优势,已经成为残留DNA检测的未来趋势。《美国药典》43版将qPCR法作为生物制品宿主残留DNA检测的唯 一方法,《中国药典》2020年版也在通则3407 外源性DNA残留量测定法中新增定量PCR法。
睿科集团推出自主研发的生物制品宿主DNA残留检测试剂盒,满足各国监管机构的法规要求,为工艺研究开发和生产质量控制提供准确可靠的检测手段,助力生物制品行业发展。
产品介绍
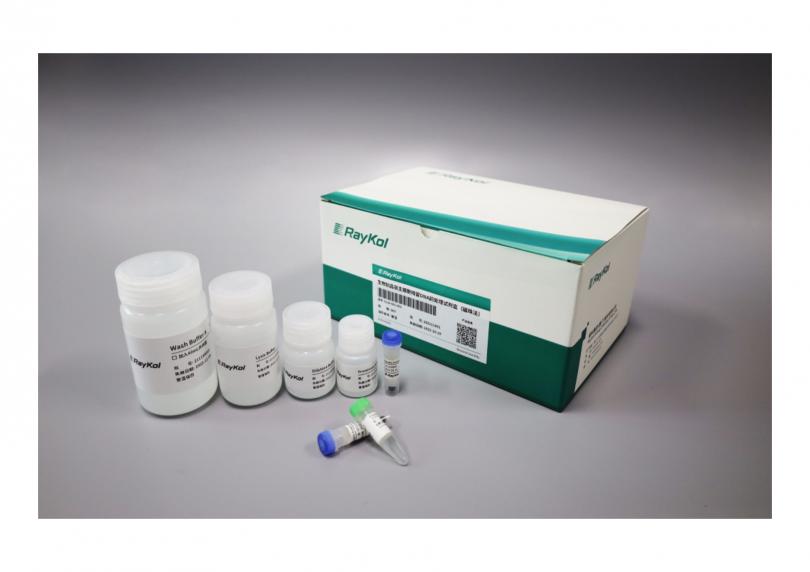
生物制品宿主细胞残留DNA前处理试剂盒(磁珠法)
用于生物制品样品的前处理,适用于提取各种生物制品的中间品、原液、半成品和成品中残留的宿主 DNA。
* 可手工提取,亦可搭配睿科仪器实现自动化前处理。
 |
|
生物制品宿主细胞残留DNA检测试剂盒(qPCR-探针法)
对使用样本前处理试剂盒提取的样本中的残留DNA进行荧光探针qPCR定量。
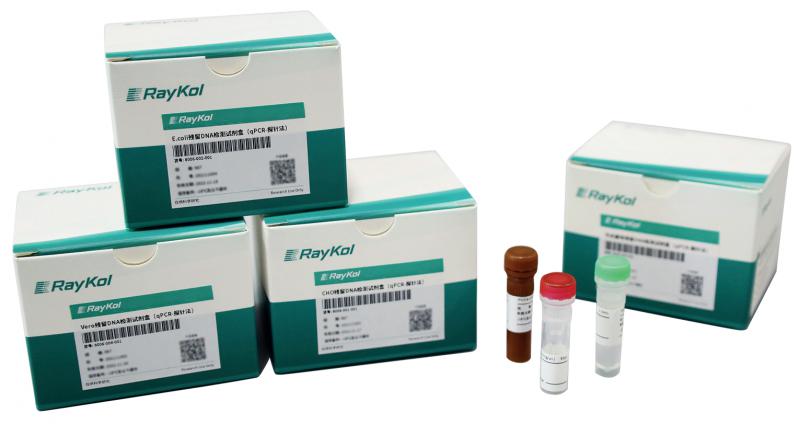
· CHO残留DNA检测试剂盒
· E.coli残留DNA检测试剂盒
· 毕赤酵母残留DNA检测试剂盒
· Vero残留DNA检测试剂盒
· Human 残留DNA检测试剂盒(即将上市)
· 293T残留DNA检测试剂盒(即将上市)
产品优势
■ 特异性强、结果准确、重复性好
■ 宽线性范围,灵敏度高
■ 与《中国药典》2020年版,《美国药典》43版,《欧洲药典》10.0版方法一致
■ 溯源至国家标准品(1)
■ 通过《中国药典》通则9101和ICH Q2(R1)方法学验证
■ 组分简单,操作简便快捷
■ 高通量,适配睿科生物制品自动化前处理系统
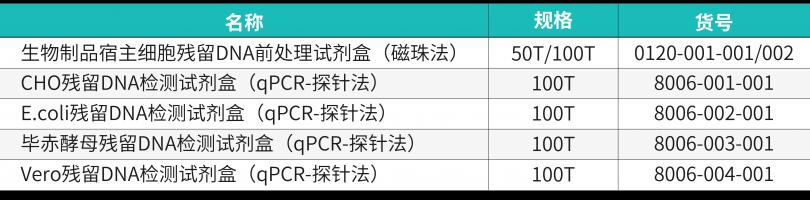
产品规格
参考文献
[1] WHO. WHO Expert Committee on Biological Standardization: Forty-seventh Report. Requirements for the use of animal cells as in vitro substrates for the production of biologicals. World Health Organization Technical Report, 1998, 878.
[2] FDA. Points to Consider in the Manufacture and Testing of Monoclonal Antibody Products for Human Use. 1997.
[3] European Pharmacopoeia Commission. European pharmacopoeia 10.0. 2020.
[4] 国家药典委员会. 中国药典(三部). 2020.
注:(1)无毕赤酵母DNA定量国家标准品
睿科集团股份有限公司
仪器网(yiqi.com)--仪器行业网络宣传传媒