| 行业应用: | 农林牧渔 综合 |
原文以 Simultaneously measuring carbon uptake capacity and chlorophyll a fluorescence dynamics in algae为标题发表在Algal Research(IF=4.401)上。
作者 | Jason Hupp, Johnathan I.E. McCoy, Allen J. Millgan, Graham Peers
翻译 | 子毅&王军
量化藻类的光合固碳和叶绿素荧光参数非常重要。
研究者们报告了一种用于藻类光合-荧光同步测量的全新研究工具—6800-18藻类和水生植物光合作用测量系统。
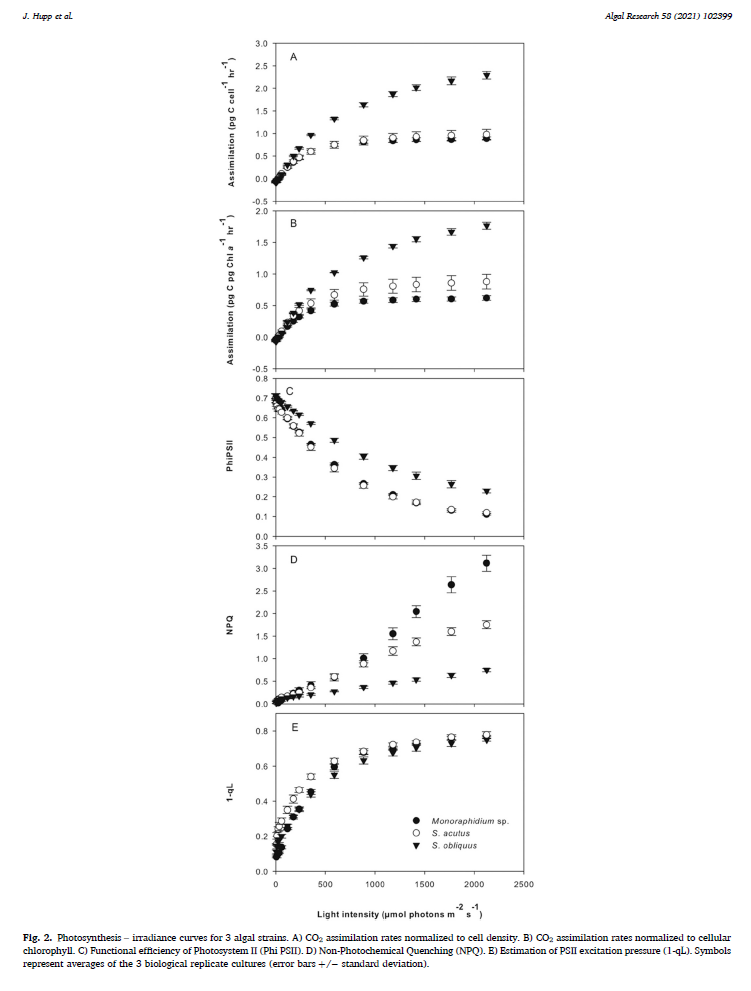
他们选取三种不同的真核微藻作为实验材料,使用6800-18测量了其荧光-光响应曲线。
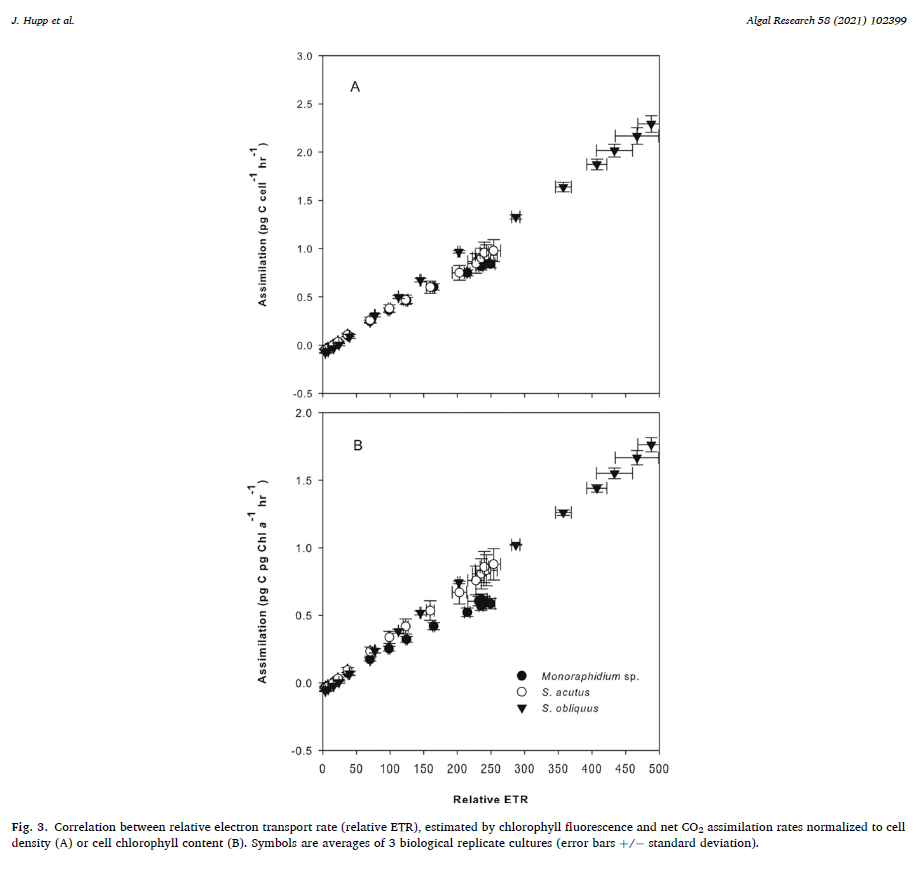
数据显示,即便是在全日照条件下(>1800 μmol m-2 s-1),Scenedesmus obliquus 碳同化速率仍未达到饱和;Monoraphidium sp.在高光下的非光化学淬灭能力很强;在低光环境下(< 500 μmol m-2 s-1),三种微藻的碳同化速率和相对电子传递速率表现出很好的线性关系。
本研究表明,6800-18藻类和水生植物光合作用测量系统能用于快速评估微藻的光合固碳能力。
6800-18藻类和水生植物光合作用测量系统在本研究中的作用

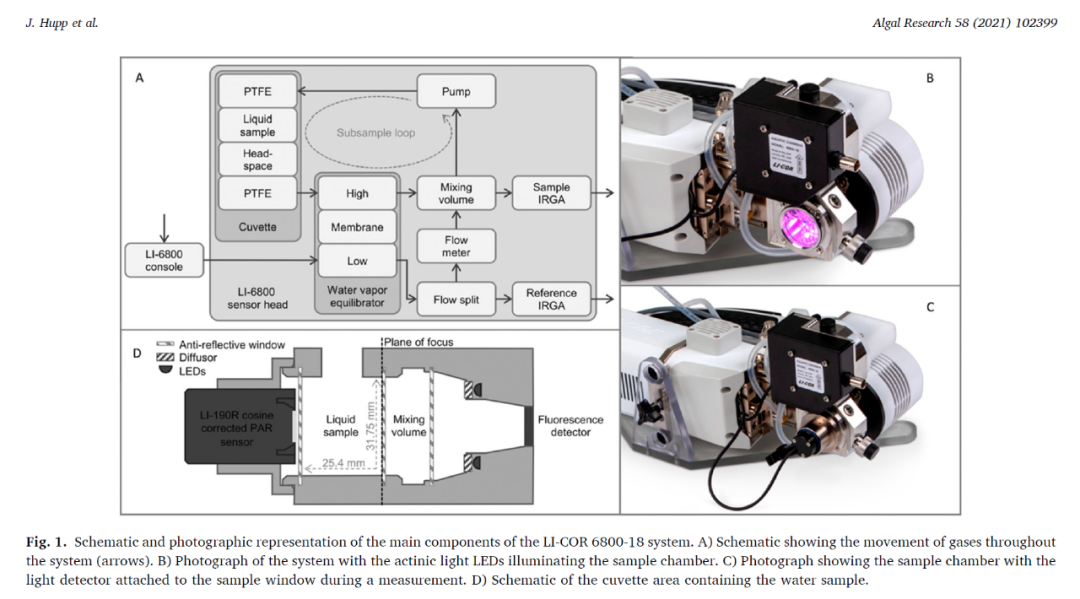
6800-18藻类和水生植物光合作用测量系统
使用6800-18同步测量三种微藻的光合碳同化和叶绿素荧光参数。藻类悬浮液被盛放在一个圆柱形的样品室内,该测量室直径31.75mm,长度25.4mm。光源型号为6800-01A。
控制进气CO₂浓度400 μmol mol-1,水汽浓度20 mmol mol-1,样品流速控制为600 μmol s-1,控制Subsample泵的电压4.5V,对应流速为240 μmol s-1。红光和蓝光的比例设置为1:1。
首先对样品进行30min暗适应,之后测量其荧光-光响应曲线。光强梯度由低到高设置:0,5,10,20,30,50,100,150,200,300,500,750,1000,1200,1500,1800,单位是 μmol m-2 s-1。
光强在300 μmol m-2 s-1以下时,每一个光强下的等待时间为480s;光强在300 μmol m-2 s-1以上后,每一个光强下的等待时间为600s。使用15s碳同化速率的平均值作为ZZ值记录。
首先测量15ml预平衡培养基液的“碳同化”。基液中没有藻类细胞,该数据作为测量系统所能检测到的“Z小通量”。
光合碳同化数据做标准化处理,核算为单一细胞和单一叶绿素a的光合速率。
根据光响应曲线,计算ZD净光合速率(Pmax)、Minimum Saturating Light Intensity(Ik)和表观量子效率(α)。
采用多相闪光测量技术(MultiPhase Flash)测量叶绿素荧光Fm'。光强为12500 μmol m-2 s-1,调制频率是250kHz。
在测量暗适应下的Z小荧光值Fo时,调制频率设置为2 kHz(光强对应为0.2 μmol m-2 s-1);在测量光下稳态荧光值Fs时,调制频率设置为10 kHz(光强对应为1.0 μmol m-2 s-1)。
评估蓝光对Fv/Fm的增强作用。测量暗适应微藻细胞的Fv/Fm,之后暴露在微弱的蓝光下10分钟,蓝光光强设置为10 μmol m-2 s-1,之后再次测量Fv/Fm。
对于S. acutus 和 S. obliquus来说,测量其Fm'之后,随之测量Fo'。使用25 μmol m-2 s-1的远红光对其照射6s,之后是15s的暗适应,取暗适应过程中的荧光Z小值作为Fo'。
对Monoraphidium sp.来说,Fo' 使用计算的方法获得。
原文中的主要数据图

北京力高泰科技有限公司
仪器网(yiqi.com)--仪器行业网络宣传传媒