| 行业应用: | 食品/饮料/烟草 蔬菜/水果及制品 |
1. 引言
虾青素来源有两种,天然提取和人工合成 [1] [2]。目前天然虾青素的来源中,以微藻的前景Z为广阔,特别是雨生红球藻。雨生红球藻中的虾青素以其高活性及高含量,成为近年来的研究热点。虾青素也广泛存在于生物界,特别在虾、蟹、鱼体内含量较高,是海洋生物体内主要的类胡萝卜素之一。另外,一些藻类也能产生虾青素,例如雨生红球藻、绿球藻等微藻及海带等大型海藻中都有虾青素的分布。虾青素的化学名为3,3’-二羟基-β,β’-胡萝卜素-4,4’-二酮,分子式C40H52O4,相对分子质量596.86,是一种萜烯类不饱和化合物,其化学结构由4个异戊二烯单位以共轭双键的形式连接,在其两端2个烯酮单位组成的六元环结构,和β-胡萝卜素的结构相似,其结构式如下图1所示。

Figure 1. The structure of astaxanthin
图1. 虾青素的结构
2. 虾青素用途
在食品领域中,虾青素可以用于饮料、食品、调料的着色,还可以有效地起保鲜作用。
在化妆品领域中虾青素更是因其抗氧化功效被广泛应用,虾青素有着强大的抗氧化作用,可用于对皮肤的保护。因能够减弱活性氧(ROS)和基质金属蛋白酶(NMP)对真pi层胶原蛋白和弹力蛋白的破坏,保证了皮肤的正常代谢,从而使得紫外线损伤的皮肤快速得以修复。
在医疗方面,有研究证实虾青素可以缓解疲劳、增强免疫力、抗炎抗感染等,也可以用于心脑血管疾病的预防甚至抑制肿瘤的形成 [3] [4]。
目前虾青素已经有商品化的产品,大部分用于化妆品领域。虾青素具有抗氧化作用,可对皮肤起到一定保护,防止皱纹的出现及色素沉着的加重,目前市面有虾青素胶囊,虾青素片,富含虾青素的精华液以及虾青素面膜等,其中虾青素的含量有4 mg,12 mg不等。
3. 虾青素的提取工艺
虾青素广泛存在于生物界中,一些藻类也能产生虾青素,例如雨生红球藻、绿球藻等微藻及海带等大型海藻中都有虾青素的分布。目前在天然虾青素的来源中,以微藻的前景Z为广阔,特别是雨生红球藻。由于雨生红球藻的虾青素含量Z高可达5%以上,远高于其他原料,利用雨生红球藻提取虾青素,极具大规模工业化生产潜力,目前国内也已经开展了雨生红球藻的规模化养殖。
雨生红球藻隶属绿藻门、团藻目、红球藻科、红球藻属,雨生种。其细胞壁较厚,加大了从中提取虾青素的难度,采用有机溶剂直接萃取的方式,会大大降低虾青素的提取率,因此对雨生红球藻细胞进行有效的破壁处理是虾青素提取工艺中的关键步骤,目前从雨生红球藻中提取虾青素分为两个步骤:破壁和提取。
破壁:雨生红球藻的厚壁孢子具有坚韧的细胞壁,使得虾青素直接提取率较低。通常需在提取前需将红球藻进行破壁处理,且虾青素属于热敏性较高的物质,提取过程中易于分解。目前常用的破壁方法主要有:珠磨法、高压均质法、冷冻法、匀浆法、超声波法、冻融法、机械研磨法、液氮冷冻法、酶法和化学法等。但对雨生红球藻进行破壁处理,极易造成虾青素的损失,如酸法破壁法,该方法额外在体系中添加了酸作为破壁溶剂,增加了产品分离的难度,且酸液不易于回收利用。有些破壁效果较好,因设备要求较高,不利于放大生产,如高压均质破壁法,该方法破壁需要经过反复多次处理,耗时较长从而导致有效成分被氧化,此外红球藻在溶液中极易沉降,导致料液不均匀从而堵塞仪器;超高压破碎该方法采用100~300 mpa高压破碎,破壁率超过95%,效果较好但对设备要求较高,不易在规模化生产中应用 [5]。所以找到合适的并可以在生产中规模化应用的破壁方法是实验成功关键之一。
提取:从雨生红球藻中提取虾青素主要有以下几种方法:超临界CO2萃取法、有机溶剂提取法、高压均质提取法、油提取法和我们的微波提取法等。采用超临界CO2萃取技术萃取虾青素是目前国内外研究的热点技术,该工艺绿色安全环保,但是该方法对设备要求较高,不易放大生产,该方法和高压均质提取法常用于实验室研究,因设备投入成本较高,较难工业化生产;油提取法的提取效果较好,但因油难以除去而降低了虾青素的含量,品质难以提升;有机溶剂提取法生产成本较低,方法简便,提取率较高,后期处理方便。因此,有机溶剂萃取法在生产中较为常用 [6]。我们实验室正在应用北京祥鹄微波和超声波化学仪器改进虾青素的提取工艺。
4. 虾青素的合成
关于虾青素的主要合成路线,按照合成原料结构式的含碳数可以包括有三条 [7] [8]:一是2C10 + C20 → C40路线,二是2C6 + C10 + 2C9 → C40路线,三是2C15 + C10 → C40路线。第三条路线已经由众多公司实现了工业化,该路线的综合策略在于先通过各种途径反应生成相应的C15磷叶立德,再使用C10二醛发生经典的双Wittig反应生成C40虾青素。其中本实验室采用的是线路三的路线,但是在C15的合成中采用了更为温和高效的方法,使得合成更为安全。以下针对各个路线作一概述 [4]:
合成路线一 [9]:是由两分子的甲氧基异戊二烯(1)和C10-二醛二甲基缩醛(2)反应生成C20-二醛二甲基缩醛(4)结构,在与两分子的C10-二烯醚(5)反应生成虾青素(7)。反应具体路线如下图2所示。

Figure 2. The synthesis of astaxanthin
图2. 虾青素的合成
该反应Z关键的过程为1,5号化合物的合成,根据参考文献 [9] 得出化合物1的制备过程如下图3。

Figure 3. The synthesis of compound 1
图3. 化合物1的合成
化合物5是该方法中制备虾青素的重要原料,其反应原理如下图4。

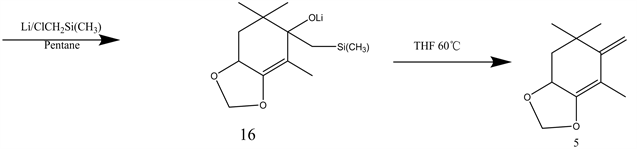
Figure 4. The synthesis of compound 5
图4. 化合物5的合成
化合物1,5是合成线路一的关键原料,正因为其合成的复杂性以及危险性,导致该路线是合成虾青素的难点之一。
合成路线二 [10]:其具体步骤为以C6醇(17)为原料,生成C6膦盐(18)后,两分子的18和C10-二醛(19)反应,生成C22的共轭二炔多烯化合物(20),再与C10-二烯酮(22)反应,经过还原后,生成虾青素(7)。反应路线如下图5。

Figure 5. The synthetic route 2 of astaxanthin
图5. 虾青素的合成路线二
其中原料8和13是制备虾青素的关键产品,原料8属于维A醇,但其价格十分昂贵,成为该反应的制备的一大难题。原料13与上述原料5制备基本相似。
合成路线三:
该线路已经在国外的罗氏公司、BASF公司实现了工业化,因此该路线也更适合应用于工业大规模生产。该反应分为两部分:C9 + C6 = C15和C15 + C10 + C15 = C40。
C9的合成:以氧代异佛尔酮为起始原料,双键在碱性条件下环氧化,碱性水解,氢化还原,羟基和羰基的双护,得到重要中间体C9合成单元。该路线与上述化合物11合成15路线一致。
C6单元的合成两公司有着轻微的区别:
罗氏公司C6单元的合成:丙酮和甲醛水溶液在微碱性条件下发生羟醛反应得到羟基丁酮,草酸脱水得到丁烯酮,同乙炔加成,硫酸重排得到重要的中间体六碳醇,此化合物是合成维生素A的重要中间体,将其羟基保护后得到此路线合成虾青素的C6合成单元。如下图6。
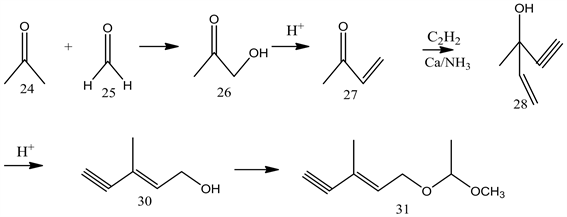
Figure 6. The synthesis of compound 31
图6. 化合物31的合成
BASF公司前面三步反应同罗氏公司采用的合成工艺路线一样得到C6叔醇,但生成的叔醇不用酸催化重排转位,而是将羟基直接保护后去与C9单元反应。其反应路线如下图7 [8] [11]。

Figure 7. The synthesis of compound 29
图7. 化合物29的合成
罗氏公司C15单元的合成:C6合成单元的炔基用二异丙氨基锂处理后与C9合成单元的羰基加成,在酸催化下水解脱保护和叔醇脱水,再选择炔键还原成双键,与三苯基膦溴化氢反应得到C15三苯基盐 [12] [13] [14],如下图8。

Figure 8. The synthesis of compound 35
图8. 化合物35的合成
BASF公司路线对C15合成单元的合成:C6合成单元的炔基与锂试剂作用形成炔基锂,与C9合成单元的羰基加成得到C15骨架,水解脱水脱保护,三键部分氢化形成双键,得到的叔醇再与三苯基膦溴化氢复合物反应得到C15三苯基膦盐。如下图9。

Figure 9. The synthetic route 2 of compound 35
图9. 化合物35的合成路线二
Z后2分子C15和C10进行经典的Wittig反应合成虾青素,反应式如下图10。

Figure 10. The synthetic route 3 of astaxanthin
图10. 虾青素的合成路线三
实验室应用C15 + C10 + C15 = C40的方法,应用的是C13 + C2 = C15。后续的2分子C15和C10进行经典的Wittig反应合成虾青素跟上述方法一致。该方法合成路线优点是反应较为温和。其合成路线为 [15] [16]:以α-紫罗兰酮(43)为起始原料,经过7步反应生成C15三苯基膦(35)结构,再与C10-多烯二醛反应,Z终生成虾青素(7)。具体路线如下图11:

Figure 11. Laboratory synthesis of astaxanthin
图11. 虾青素的实验室合成
从反应三条线路中都可以看出2,7,-二甲基-2,4,6-辛三烯-1,8-二醛(19)结构是反应中关键的中间体,线路一中的(4)是C10的两个醛基进行保护,所以需要进行C10结构的合成,现在概述主要的合成路线 [6]。
方法一为BASF公司以1,4-二卤-2-丁烯(39)为原料,经Abrozov重排反应得到双磷酸酯化合物,再与丙酮醛缩二甲醇进行Wittig-Horner反应、脱保护基得到十碳三烯双醛 [17] [18] [19],其反应式如下图12。

Figure 12. The synthesis of compound 19
图12. 化合物19的合成
方法二是Hagen以苯亚磺酸钠为连接剂,与两分子的2-(3-氯-1-甲基-1-丙烯基)-5,5-二甲基-1,3二噁烷合成砜化合物,再通过强碱消除Z终得到2,7,-二甲基-2,4,6-辛三烯-1,8-二醛 [20]。如下图13。

Figure 13. The synthetic route 2 of compound 19
图13. 化合物19的合成路线二
方法三是以呋喃为起始原料,与甲醇经过两步加成得到1,l,4,4-四甲氧基-2-丁烯,此双缩醛化合物在路易斯酸催化下与丙烯基甲醚缩合反应得到C10骨架,再经碱处理消除甲醇形成双键得到目标产物。此路线的缺点是丙烯醚原料难得,且化学性质不稳定,与缩醛的加成反应副产物较多 [4]。
5. 虾青素的生物活性研究
虾青素是一种含氧的类胡萝卜素,其分子结构中碳骨架由多聚烯链和位于两侧的芳香环组成,同时芳香环上含有羟基和酮基。近年来,国内外大量研究表明,因虾青素独特的化学结构,使其具有很强的抗氧化活性,可以预防ai症、动脉粥样硬化、糖尿病等慢性病的发展,具有提高免疫力、延缓衰老有积极作用。
虾青素是一个非常优良的具有抗氧化清除氧自由基功效的化学物质。现已经探明,人体内存在的氧自由基,是百病之源、衰老之魁。这些自由基也被称为“氧毒”,它们是不成对电子的原子、分子,对人体器官组织和免疫系统具有很强的攻击能力。如:攻击细胞膜、脂蛋白、侵蚀胰岛细胞、损害关节膜、侵蚀晶状体和脑细胞、攻击毛细血管、攻击人体免疫系统、激发人体释放因子、攻击复制中的DNA等。实验证明,虾青素在防止亚油酸自氧化、清除羟自由基、清除1,1-二苯代苦肼基(DPPH)的实验中,都表现出良好的效果。也正因为其化学结构不同于其他类胡萝卜素,除了有长的共轭双键外,在两端的芳香环中的羟基和不饱和酮基具有活泼的电子效应,能向自由基提供电子或吸引自由基的未配对电子。达到清除自由基的目的 [21]。
除了强大的抗氧化活性外,虾青素还具有抗动脉粥样硬化、抗ai活性和增强免疫功能的活性。研究表明,虾青素可以升高高密度脂蛋白(HDL),降低低密度脂蛋白(LDL)。对于动脉粥样硬化有很好的预防作用 [22]。越来越多的研究表明,虾青素具有抑癌、抗ai作用,这些作用主要体现在虾青素预防肿瘤的发生、抑制肿瘤细胞增殖、促进肿瘤细胞凋亡、抑制肿瘤转移、增强免疫、增加细胞间通讯等方面 [23]。另外,有动物实验发现,虾青素会增加IL-2的产生,并能促进脂多糖诱导的淋巴细胞的增殖。虾青素可以增强pizang细胞对抗原的免疫应答,增强抗体的生成 [24] [25],促进免疫细胞的增殖以此来增强免疫功能。
由于虾青素结构中有两个手性中心,分别是两端环结构的C-3和C-3’,两个手性碳均可以R或S构型存在,所以虾青素存在光学异构体,分别为3R,3’R,3S,3’S,和内消旋体。不同结构其生物活性会有区别 [26],雨声红球藻中的虾青素均以反式结构存在,并且是3S,3’S的结构,实验表明,虾青素无论是清除自由基的能力还是提高免疫活性的能力,其内消旋结构活性都是Z差的。所以纯化虾青素也是提高其生物活性的一大优势。
6. 小结与展望
越来越多的实验表明虾青素具有强大的抗氧化能力,其强抗氧化能力已经逐渐进入到食用色素、畜牧业和水产品的饲料添加剂中,也广泛应用于化妆品、保健品和医药等行业中 [27]。当然,虾青素的抗氧化机制及作用为预防和治疗肿瘤、心血管疾病及各种慢性疾病提供了理论基础。虽然关于虾青素研究已经取得了很大的进展,但未来我们仍需要不断的实验研究,找到更安全的简便的方法来提取和合成虾青素,我们实验室正在应用祥鹄微波化学系列仪器改进虾青素的萃取方法和合成路线 [28] [29],为进一步研究虾青素的生物活性、构效关系及其工业化提供基础。
NOTES
*通讯作者。
参考文献
| [1] | 李元广, 章真, 等. 一种利用微藻高效生产虾青素的方法[P]. 中国专利, CN103571906A. 2014. |
| [2] | 李悦明, 管松, 等. 一种从雨生红球藻中提取虾青素的方法[P]. 中国专利, CN103787941A. 2014. |
| [3] | 解温品, 秦士新. 自由基医学研究进展[J]. 中华损伤与修复杂志, 2012, 7(2): 194-195. |
| [4] | 李勇, 孔令青, 等. 自由基与疾病研究进展[J]. 动物医学进展, 2008, 29(4): 85-87. |
| [5] | 许晟, 陈可泉, 等. 一种雨生红球藻细胞快速破壁偶联萃取虾青素的方法[P]. 中国专利, CN106748944A. 2017. |
| [6] | 杨枝中, 万近福, 等. 一种从雨生红球藻中提取虾青素(油)的方法[P]. 中国专利, CN108440359A. 2018. |
| [7] | George, S., Schloemer, C.A., et al. (2002) Preparation of 4,4’-Diketo-Beta, Beta-Carotene Derivaives. US, 6372946. |
| [8] | Widmer, E., Zell, R., Broger, E.A., et al. (1981) Technical Procedures for the Synthesis of Carotenoids and Related Compound from 6-Oxo-Isophorone. Helvetica Chimica Acta, 64, 2419-2446. |
| [9] | Rüttimann,
A. (1999) Dienolether Condensations—A Powerful Tool in Carotenoid
Synthesis. Pure and Applied Chemistry, 71, 2285-2293. https://doi.org/10.1351/pac199971122285 |
| [10] | 陈志荣, 李浩然, 王纯超, 等. 一种虾青素的合成方法[P]. 中国专利, CN1260211C.2004. |
| [11] | Bernd, R., Petra, D., Thomas, M., et al. (2006) Method for Producing Astaxanthin and Canthaxanthin Intermediate Products: WO. |
| [12] | Ernst, H. 虾青素的制备, 制备它的新中间体以及其制备[P]. 中国专利, ZL94108274.1. |
| [13] | Ernst, H., Paust, J., et al. (1993) Preparation of Canthaxanthin and Astaxanthin. US5210314. |
| [14] | Krause, W., Henrich, K., Paust, J., et al. (1997) Preparation of Astaxanthin. |
| [15] | 皮士卿, 陈新志, 胡四平, 等. 虾青素的合成[J]. 有机化学, 2007, 27(9): 1126-1128. |
| [16] | 皮士卿. 类胡萝卜素合成工艺研究[D]: [博士学位论文]. 杭州: 浙江大学, 2008. |
| [17] | 田金金, 吕国锋, 管敏虾, 等. 一种虾青素中间体的合成方法[P]. 中国专利, CN10911883. 5. 2018. |
| [18] | Babler, J.H. (1992) Method of Making 2,7-Dimethyl-2,4,6-octatrienedial and Derivatives Thereof. US, 5107030A. |
| [19] | Bemhard, K. and Mayer, H. (1991) Recent Advances in the Synthesis of Achiral Carotenoids. Pure and Applied Chemistry, 63, 35-44. https://doi.org/10.1351/pac199163010035 |
| [20] | Jaedicke, H., Kaiser, K. and Amm, H.M. (1993) Process for the Preparation of Polyenes via Julia Reaction in Ketone and Other Solvents. EP, 523534A2. |
| [21] | 陈晋明, 王世平, 马俪珍, 等. 虾青素抗氧化活性研究[J]. 营养学报, 2007(2): 163-165, 169. |
| [22] | Murillo, E. (1992) Hypercholesterolemic Effect of Canthaxanthin and Astaxanthin in Rats. Archivos Latinoamericanos De Nutrición, 42, 409. |
| [23] | 吕亭亭, 葛声. 虾青素抗肿瘤作用的研究进展[J]. 肿瘤代谢与营养电子杂志, 2015(4): 58-62. |
| [24] | Jyonouchi, H., et al. (1995) Astaxanthin, a Carotenoid without Vita-Min a Activity, Augments Antibody Responses in Cultures Including T-Helper Cell Clones and Suboptimal Doses of Antigen. Journal of Nutrition, 125, 2483-2492. |
| [25] | Jyonouchi,
H., Sun, S., Mizokami, M. and Gross, M.D. (1996) Effects of Various
Carotenoids on Cloned, Effector-Stage T-Helper Cell Activity. Nutrition
and Cancer, 26, 313-324. https://doi.org/10.1080/01635589609514487 |
| [26] | 孙伟红. 不同来源虾青素的分离制备及其构效关系研究[D]: [博士学位论文]. 青岛: 中国海洋大学, 2015. |
| [27] | 江利华, 柳慧芳, 郝光飞, 等. 虾青素抗氧化能力研究进展[J]. 食品工业科技, 2019, 10(40): 350-354, 195. |
| [28] | 胡曌玺, 王存文, 闵清, 尤进茂, 马密霞, 胡文祥. 微波化学研究进展——京东祥鹄微波化学联合实验室微波化学领域相关研究成果目录及部分论文集[M]. 武汉: 汉斯出版社, 2019. |
| [29] | 秦宁, 闵清, 马密霞, 胡文祥. 微波辅助提取中药成分研究进展[J]. 微波化学, 2018, 2(3): 79-84. https://www.hanspub.org/journal/PaperInformation.aspx?paperID=27557 |


北京祥鹄科技发展有限公司
仪器网(yiqi.com)--仪器行业网络宣传传媒