| 行业应用: | 制药/化妆品 综合 |
摘要
注射用水(WFI)和药品纯净水(PW)的总有机碳(TOC)分析要求在美国药典(USP)和欧洲药典(EP)都有ZT论文提供。这些方法背后的原理是通过比较标准溶液(rs)和系统适用性解决方案(rss)的回收率来验证仪器的氧化效率。用于配置这些溶液的水-试剂水(rw)的响应,要从这些溶液的响应中减去,得到一个正确的响应。试剂水的ZD碳浓度被限制在百万分之100 (ppb C),根据修正后的响应结果,计算分析的响应效率(E)。根据药典,E的值需要在85% - 115%之间,该仪器才能适用于PW和WFI样品的TOC分析(见公式1-3)。本文概述了现代TOC分析仪的特点,它通过无人值守的自动化性能提高了实验室系统适用性性能的寿命。

R1 = rs–rw
R1 = corrected standard solution response (修正后标准溶液的响应)
rs = standard solution response (标准溶液的响应)
rw = reagent water response (试剂水的响应)
Equation 1. Corrected Standard Solution Response is theLimit Response(修正后的标准溶液响应是极限响应)
R2 = rss – rw
R2 = corrected system suitability solution response (系统适用性修正后溶液的响应)
rss = system suitability solution response (系统适用性中溶液的响应)
rw = reagent water response (试剂水的响应)
Equation 2. Corrected System Suitability SolutionResponse (系统适用性修正后溶液的响应)
E = (R2 / R1) * 100
E = % response efficiency (百分比响应效率)
R2 = corrected system suitability solution response (系统适用性修正后溶液的响应)
R1 = corrected standard solution response (修正后标准溶液的响应)
Equation 3. Response Efficiency (响应效率)
自动化仪器具有校准功能
Teledyne Tekmar的Fusion TOC分析仪使用对用户友好的软件--TekLink,比以往任何时候都更强大,更容易导航驾驭。TekLink有多个用户定义的方法参数,允许ZZ用户定制仪器,以满足其特定的样品需求。Fusion为各种样品应用提供了优越的分析分析。对于USP / EP系统适用性测试,Fusion采用默认的制药TOC方法,为注射用水(WFI)提供zui佳性能,超低纯净水。此外,该方法的稳定特性足以处理zui具挑战性的清洗验证样本。
Fusion分析仪有一个集成的自动进样器,有四个可以容纳125ml容量瓶的ZX库存溶液位置,如图1。将125毫升的瓶子放置在自动进样器的A、B、C或DZX位置,可以对系统适用性测试试剂、标准溶液和挑战性溶液进行多次无人值管的分析。该特性允许系统适用性测试可以从ZX位置以多个间隔运行,因此,允许在自动取样器中为样品瓶提供额外的样品位置。通过使用更大的样品容器来增加系统的适用性频率,减少了无效样本结果的风险。通过使用USP和NIST认证的预先制定的TOC标准、试剂和纯化水,可以进一步提高实验室效率并降低风险。
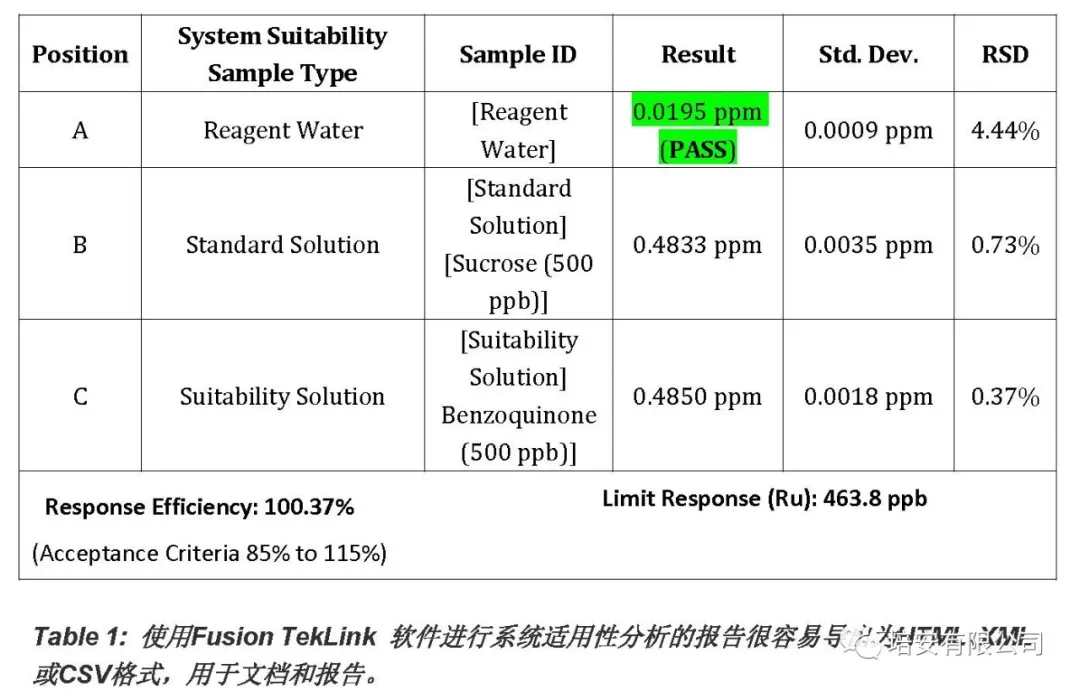
旧TOC分析仪的软件需要额外的软件,如电子表格完成系统适用性计算。因此,该过程需要多个集合和数据的转移以执行药典分析。不同于老软件,TekLinkTM软件有自动通过/失败的警报系统适宜性性能。如果结果超出了由ZZ用户设定的技术参数,那么软件可以自动重新校准,停止或继续计划的分析。Fusion TOC 分析仪典型的系统适用性分析的自动取样器计划和报告见表1。

Figure 1: Fusion在自动进样器ZX位置使用四个波士顿圆瓶(125mL)进行校准、校准验证和系统适用性分析
为了便于校准和校准验证,Fusion可以使用第四个125mLZX储备液位置。从一个原液,通过TekLink软件自动稀释后,可以得到13个校准点。利用ZX位置进行校准和验证,额外的样品位置可用于WFI、纯化水和清洗验证分析。
改进系统适用性测试和TOC的分析
每个药物实验室的目标是用无效结果的ZD量进行TOC分析。通过利用自动化和报告方面的zui新技术,Fusion TOC分析仪提供了独特的功能,可以节省时间和增加实验室的实验量,使系统适用性性能分析的任务更容易进行合规监测。此外,成功的系统适用性结果细节以及所有元数据(校准曲线,方法,电子签名和审计跟踪细节)都记录在样本分析报告中。
参考文献
1. USP 30 / NF 25<643>United States Pharmacopeia and the National Formulary. The OfficialCompendia of Standards.
2. “European PharmacopoeiaMethod 2.2.44 – Total Organic Carbon in Water for Pharmaceutical Use/ Carboneorganique total dans l’eau pour usage pharmaceutique” European PharmacopoeiaCommission. Implemented 1 July 1999.
3. “Public Health Committee(Partial Agreement) Resolution AP-CSP (99) 1” Convention on the Elaboration ofa European Pharmacopoeia. 1 March 1999.
4. B.Wallace and S.Lawson “Why Total Organic Carbon(TOC) Is Often Superior to HPLC for Cleaning Validation Sample Analysis: A RealWorld Example” Whitepaper. Teledyne Tekmar / KnowPharma.com. March 2007.
5. USFDA. Guide to Inspections of Validation of CleaningProcedures, July 1993.
6. USFDA. Current Good Manufacturing PracticeRegulations, 21 CFR 211.67.
7.http://www.fda.gov/cder/guidance/cgmps/equipment.htm#toc
8. J.G. Jin and Cheryl Woodward, “Development of TotalOrganic Carbon Analysis for Detergent Residue Verification,” J. ValidationTechnology, Vol. 7 No. 4, 2001, pp. 278 – 284.
9. Teledyne Tekmar certified, pre-made TOC standards.
10. “Validation Support Package for the Fusion TotalOrganic Carbon Analyzer and its Accessories.” Teledyne Tekmar. Mason, OH.November 2007.

培安(中国)有限公司
仪器网(yiqi.com)--仪器行业网络宣传传媒