
立即扫码咨询
联系方式:400 820 3586
联系我们时请说明在仪器网(www.yiqi.com)上看到的!
介绍
自 20 世纪 60 年代发现绿色荧光蛋白以来,各种荧光蛋白(FP) 及其变体已被开发出来,跨越整个可见光谱。这些基因编码的荧光蛋白在细胞生物学领域引发了一场革命。蓝绿色荧光蛋白 (CFP) 因其在 FRET 等多色领域的应用而受到广泛关注。这是因为 CFP 的激发和发射光的波长范围很少使用,反而使得它成为各种荧光基团的多路复用的理想化选择。
荧光蛋白技术和自动显微镜技术的发展使研究人员能够更深入地研究活细胞中的基因功能和动态过程。荧光蛋白常被用作融合到感兴趣基因上的报告基因。一旦 FP 标记的基因产物被细胞成功表达,就可以对其进行成像,以研究蛋白质、细胞器和细胞间隔的功能并跟踪其定位。1FP 融合产物的直接可视化还有助于优化细胞中表达新遗传物质的方法。转染和转导是将核酸和蛋白质引入细胞的两种常用方法。然而每一种方法都需要详细的计划和优化时间,它们都受到基因材料导入和细胞表达效率的限制。这些因素需要使用稳健和精确的方法来评估转导或转染效率。
优势
• 在 CFP 波长范围内使用荧光基团进行多色应用
• 明场成像的细胞分析
• 使用预配置的分析模块进行转导效率的定量分析
• 通过即时分析(on-the-fly)在获取图像的同时生成数据
在本文中,我们强调了 ImageXpress Pico 自动化细胞成像分析系统和 CellReporterXpress图像采集和分析软件的效用,通过评估转导效率来优化载体浓度。我们使用 CellLight ™ Nucleus-CFP, BacMam 转导试剂瞬时转导两个细胞系,该试剂利用 BacMam 载体系统传递遗传物质。在这篇应用文章中我们阐述了在 ImageXpress Pico 上使用明场和 CFP 荧光通道获取图像,以及使用CellReporterXpress 软件进行转导效率分析。据此我们重点展示了 CFP 通道在多色成像方面的实用价值。
材料
• ImageXpress Pico 自动化细胞成像分析系统 (Molecular Devices)
• CellReporterXpress 图像获取和分析软件 (Molecular Devices)
• HeLa 细胞 (ATCC, P/N: CCL-2)
• U2OS 细胞 (ATCC, P/N: HTB-96)
• 96- 孔微孔板 (Greiner, cat #: 655090)
• CellLight Nucleus-CFP BacMam 2.0 (ThermoFisher, cat #: C10616)
• MitoTracker Deep Red FM (ThermoFisher, cat #:M22426)
• AlexaFluor 546 Phalloidin (ThermoFisher, cat #:A22283)
方法
利用 BacMam 转导试剂转导 HeLa 和 U2OS细胞
使用 ImageXpress Pico 系统进行转导分析的工作流程如图 1 所示。将 HeLa 和 U2OS 细胞铺在 96 孔的底透微孔板中,每孔 8000 个细胞。细胞在 37℃ , 5% CO2 下孵育过夜。将 CellLight Nucleus-CFP、BacMam 2.0 (BacMam
Nucleus-CFP) 分别以 25、50、75 和 100 颗粒 / 细胞 (PPC)的浓度加入孔中。该试剂由 BacMam 的主体架构组成,包含融合到 CFP 的 SV40 核定位序列。每个 PPC 浓度处理重复三次,用转导试剂在 37℃,5% CO2 下培养 19 小时。
在成像之前,将培养基和 BacMam Nucleus-CFP 从孔中取出,用活细胞成像培养基替代。
无标记和荧光成像
使用带有明场和 CFP 荧光通道的 ImageXpress Pico系统在 10X 物镜下成像。通道的曝光时间为 3 ms ( 明场 )和 1000 ms (CFP)。每孔成像 9 个 位点,占全孔的47.52%。为进行明场分析,对成像设置进行了优化,方法是对明场图像进行轻微的离焦,以增强对比度 ( 图 2 和图3 )。
多种荧光染料进行染色
在 4% 多聚甲醛固定细胞前,用 MitoTracker Deep Red染 色 30 min, PBS 洗涤 1 次。固定后,细胞经冲洗、堵塞、渗透,然后用 AlexaFluor 546 Phalloidin 染色。然后用 PBS 洗涤细胞两次,然后用 ImageXpress Pico 系统用40X 物镜和 CFP、TRITC 和 Cy5 通道成像。
转导效率的自动化图像分析
在成像过程中,使用 CellReporterXpress 中的透射光细胞分类的通用分析模块对 HeLa 和 U2OS 细胞进行即时分析(on-the-fly),以量化分析转导效率。在用户干预Z少的情况下,使用相应的分析模块对明场成像细胞图片进行量化分析,然后对细胞的 CFP 表达进行阳性或阴性评分。稍微离焦的明场图像为分析提供了Z佳对比度,如图3 所示,该分析能够准确地计数低对比度、薄层的 U2OS细胞。从分析中产生多参数结果,并提供了转导实验结果的综合视图 ( 图 4A )。这些读数包括了初单个细胞之外的综合测量结果,如阳性和阴性细胞计数和百分比,以及所有细胞和阳性细胞面积和强度。

图 1 CellLight, BacMam 转导效率检测的工作流程与 ImageXpress Pico 系统和 CellReporterXpress 软件。 U2OS 和 HeLa 细胞与 BacMam 试剂以不同的每细胞颗粒浓度 (PPC) 孵育 19 小时。使用 10X 物镜捕获图像,并即时运行(on-the-fly)透射光细胞分类分析模块。
结果
HeLa 和 U2OS 细胞转导效率的比较
分析结果表明,增加 BacMam Nucleus-CFP 的 PPC 浓度,转导效率相应增加,U2OS 细胞表现出对 BacMam 转导系统更大的敏感性( 图 4 )。在 25 至 50 PPC 浓度之间处理的两种细胞类型中可观察到Z显著的转导效率增加,但这一趋势在 Hela 细胞上表现的更明显。尽管 50 和 75 PPC 浓度处理的 HeLa 细胞没有表现出统计学差异,但 100PPC 可使 HeLa 细胞转导效率提高约 10%。对于 U2OS 细胞,这种转导效率的增加在 50、75 和100 个 PPC 处理之间没有显著差异( 图 4B )。每个 PPC 浓度在 U2OS 细胞中产生 90% 或更高的转导效率。
同样,CFP-SV40 核定位序列的整体表达也随着 PPC 浓度的增加而增加。这是通过测量正向转导细胞的 CFP 强度来评估的( 图4C)。单个细胞数据也同样验证了 Hela 和 U2OS 细胞 CFP 强度的Z高水平。具有较小面积和圆形的外观被识别为目标细胞( 图 5)。这种圆形的细胞形态学的特点是细胞进行分裂,但进行活性染色、增殖或细胞周期标记的证明也是必要的。此外通过自动化细胞显微成像观察 CFP-SV40 融合,可以发现插入的嵌合蛋白的定位。随着 CFP 表达的增加,我们注意到SV40 蛋白的胞质定位增加,如图 5C 所示。这表明,PPC 的Z佳浓度与Z高的转导效率或导入基因物质的Z佳表达和定位之间存在平衡。这些高转导效率和固定后 CFP 信号的持久性进一步证明了这种 BacMam 试剂在活细胞成像和终点法,以及固定细胞染色方面的实用价值。此外使用 ImageXpress Pico 成像 CFP标记核的能力解放了其他更常用的通道,从而可以成像其他荧光团染色的细胞结构( 图 6 )。
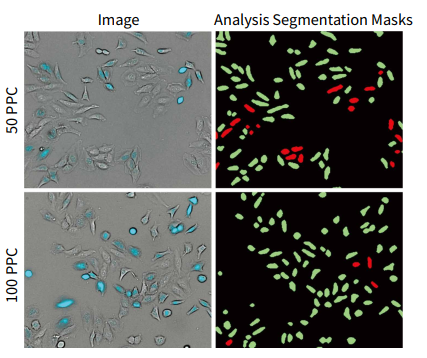
图 2 添加 CellLight Nucleus-CFP, BacMam 19 小时后 HeLa 细胞的代表性 10X 图像。( 左 )图像来自经过 50 PPC 或 100 PPC 处理的孔。与未被转导的细胞 ( 仅明场图像 ) 相比,被转导的 HeLa 细胞( 明场和CFP )可以被清晰地观察到。( 右 )利用 CellReporterXpress 软件中的通用模块透射光细胞分类,根据 CFP 的表达对细胞进行阳性( 绿色 )或阴性的转导评分。 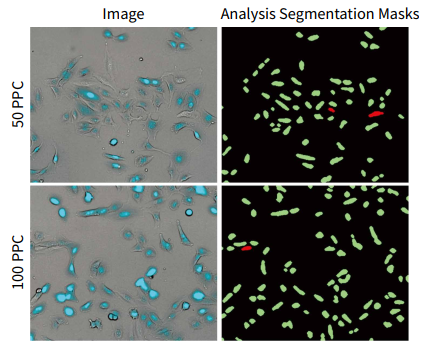
图 3 添加 CellLight Nucleus-CFP、BacMam 后 19 小时 U2OS 细胞的代表性 10X 图像。( 左 )图像来自经过 50 PPC 或 100 PPC 处理的孔。转导的 U2OS 细胞( 明场和 CFP )可以清晰地显示出来。( 右 )透射光细胞分类模块 (transmission Light Cell score) 是 CellReportXpress软件中的通用模块,用于对阳性细胞( 绿色 )或阴性细胞( 红色 )进行转导分类。
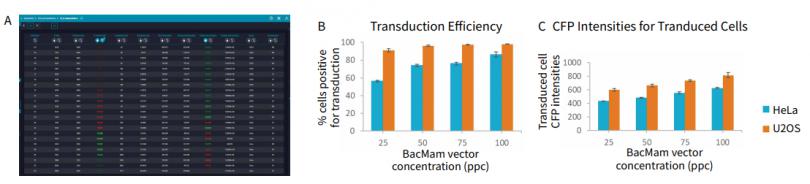
图 4 不同浓度的 CellLight Nucleus-CFP、BacMam 处理 HeLa 和 U2OS 细胞的转导效率结果的比较。 (A) 从转导效率分析中产生的多参数结果,并将测量结果显示在互动数据表上,只需轻轻一点,便可轻松导出为 CSV 文件。以热图形式展现阳性细胞率( 百分比 %,转导结果为阳性的细胞 )和阳性细胞的平均面积,并使用阳性细胞的百分率对数据表进行排序——在表的顶部出现了 % 阳性细胞Z多的孔。这一数据表明,U2OS 比 HeLa 细胞更容易转导,这是来自于对 (B) 转导阳性细胞百分比和 (C) 阳性细胞 CFP 荧光强度的分析。 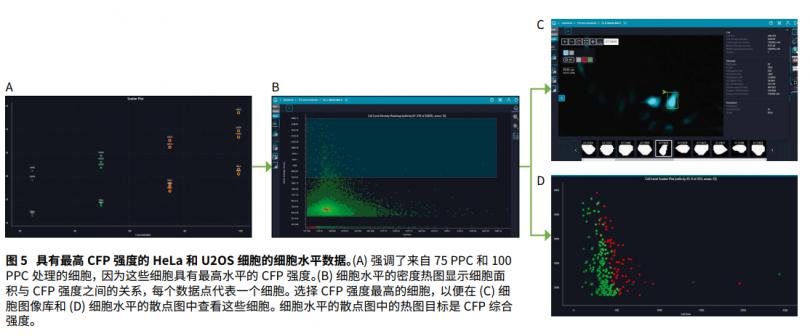
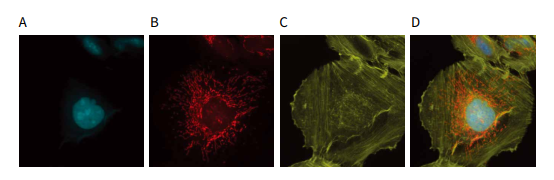
图 6 U2OS 细胞的多重染色突出了 CFP 通道在与其它的荧光团进行多路复用时的效用。 用 (A) 75 PPC 的 BacMam Nucleus- CFP 试剂( 细胞核,青绿色 )转导 U2OS 细胞,然后用 (B) MitoTracker Deep Red ( 线粒体、红色 )和 (C) AlexaFluor 546 Phalloidin( 肌动蛋白、黄色 )染色后转导 U2OS 细胞。(D) 合并后的三通道 (CFP、TRITC、Cy5) 叠加效果如图中所示。
结论
BacMam 试剂有效地转导了 HeLa 和 U2OS 细胞,并为活细胞成像应用提供了一个更常用合适的核染色替代试剂。我们展示了 ImageXpress Pico 系统和 CellReporterXpress 软件在核转导评估和定量中的应用。ImageXpress Pico 系统具有强大的聚焦性能、预配置的分析模块和数据报告,是评估和优化转导 / 转染检测的一个完整工具。此外对 CFP 荧光成像的能力为其它更常用的荧光蛋白( 如 GFP)提供了一个合适的替代方案,使得在进行细胞标记或细胞结构成像时具有更丰富的荧光通道选择。
相关产品
全部评论(0条)
推荐方案
相关解决方案
参与评论
登录后参与评论