
立即扫码咨询
联系方式:400 820 3586
联系我们时请说明在仪器网(www.yiqi.com)上看到的!
扩大针对肿瘤血管生成的自动成管分析
血管生成是指从现有血管生成新的血管,是内皮细胞萌发、增殖、迁移、侵袭和分化等多种生物学过程中的关键步骤1、2。血管生成失调是疾病状态的标志,并具有广泛的临床意义3-5。其中靶向肿瘤血管生成的疗法已成为抑制肿瘤生长的一种有前途的替代方法。为了开发针对肿瘤的治疗剂,必须建立一个能重现生理病理环境的强大体外血管生成模型,以评估内皮细胞对抑制性或刺激性化合物的反应2。管形成分析是代表体内微环境的模型之一1、6、7,它使研究人员能够通过量化源自细胞外基质中生长的内皮细胞的毛细管状管状结构来快速评估抗血管生成作用 ( 图 1 )。
本应用说明描述了我们开发的一种自动成管分析方法,它简化了图像采集和分析,这是扩大类似分析的主要瓶颈。通过结合荧光染色和高内涵成像系统,可以更好地显示完整的三维小管结构,并可以产生多种表型测量来表征抗血管生成的作用。anticancer药物苏拉明 (Suramin) 用于证明我们方法的稳健性,以确保分析通量,灵敏度和一致性。
材料
• Human umbilical vein endothelialcells (HUVEC) (ATCC, Cat #CRL-1730)人脐静脉内皮细胞
• 96-well cell culture plate 96-孔细胞培养板
• Matrigel (Corning)
• Crystal Violet (MilliporeSigma)
• Calcein AM (Thermo Fisher Scientific)
• Suramin (MilliporeSigma)
• ImageXpress Micro Confocal 高内涵成像系统和 MetaXpress 高内涵图像获取及分析软件 (Molecular Devices)
优势
• 自动化 3D 血管生成分析
• Z大限度减少量化管形成的劳动量和时间
• 生成多种表型测量
• 高密度筛选抗血管生成物质

图 1 血管形成模型原理。 将 HUVEC 与基底基质混合,然后接种到 96 孔微孔板中。 在对照组的培养条件下,毛细管状的管状结构将自发形成,而在血管形成抑制剂存在的条件下,管状结构无法形成,而是积聚成团。
方法
将 HUVEC 以每孔 15,000 个细胞铺在 96孔微孔板中的预固化基质胶上。 种上后立即用 0.4% 对照或一系列苏拉明稀释液处理 HUVEC,稀释液的浓度范围为 1.25 µM至 80 µM。 在 37°C,5% CO2 下孵育 18小时后,将细胞用 Calcein AM 或 CrystalViolet 染色。在 ImageXpress Micro Confocal 系统上,联合使用 2X Plan Apo物镜和用于 Calcein AM 和 Crystal Violet的FITC 和 Cy5 滤光片对板进行成像。由于血管在 Matrigel 中形成了三维网络,因此获得了一系列沿 z 轴的 1.3 mm 范围的图像。Best-Focus 算法将每个 z 层中的血管结构时投影到二维图像中,并通过MetaXpress 软件中的自定义模块分析所得图像。自定义模块提取并识别单个管状或结节状结构,然后输出总管长度、总管面积、管号和节点号作为读数 ( 图 2 )。为了确定苏拉明的抗血管生成能力,我们将苏拉明处理孔的结果与对照处理孔和无细胞处理孔进行了比较。苏拉明干预血管生成的有效性是通过将总管长与对照管长归一化来确定的,并采用 4 参数非线性回归拟合剂量序列。将Z小抑菌浓度 (MIC ≥30%) 评分为显著响应,并据此计算半效Z大抑菌浓度 (IC50)。
使用荧光染色剂改善管状的可视化和定量
用结晶紫染色细胞并在光学显微镜下目视检查是测量血管形成的Z典型方法。 由于内皮细胞具有在基底膜样基质中生长为三维网络的特性,并且由于明场显微镜的固有局限性,因此在不均匀光照下准确捕获所有管状结构具有一定难度 ( 图 3 A )。此外人工测量血管的形成是非常费力的,以及受到主观偏见的影响。这些缺陷损害了分析性能,限制了扩大类似分析的可能性。
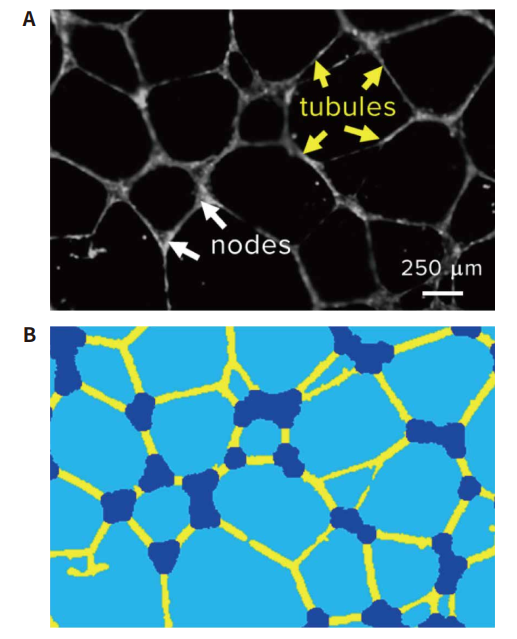
图 2 管状网络的自动定量。(A) 荧光染色显示的管状网络的代表性图像,及图像分析步骤的示例。 (B) 通过 MetaXpress 软件识别的单个小管 ( 黄色 ) 和结节 ( 蓝色 ) 的相应分割 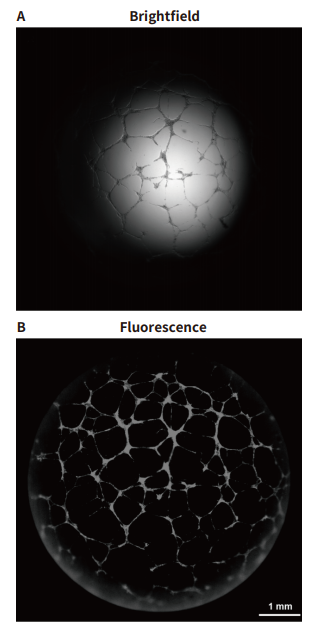
图 3 使用 2x PA 物镜的管状网络的明场与荧光全孔图像。 3D 堆叠后的荧光图像质量在视场和照明均匀性方面优于明场
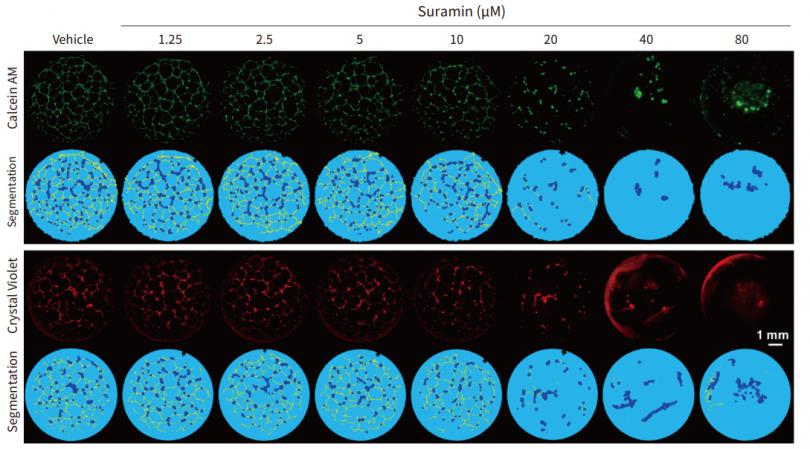
图 4 苏拉明的剂量依赖性抗血管生成作用。 HUVEC 在对照处理的孔中长成管状网络,而苏拉明处理的孔则显示出剂依赖性的血管形成减少。注意,虽然 Crystal Violet ( 下部 ) 适用于明场和自发荧光成像,但 Calcein AM 染色剂 ( 上部 ) 显示出更好的图像对比度,并且孔边缘附近的伪影更少
我们通过采用荧光染料和低倍物镜来获得管状物的全孔图像,克服了这些限制。与Crystal Violet 染色的明场图像相比,Calcein AM 的荧光或 Crystal Violet 的自发荧光可提高图像对比度,并且所得图像几乎没有晕影 ( 图 3B )。低倍物镜的较长景深和z轴自动堆叠功能还有助于捕获更多三维生长的微管。 此外 Calcein AM 染色消除了对样品固定的需要,并减少了清洗步骤,这是造成血管破裂或其他伪影的潜在原因。
为了展示此改良方案的性能,将苏拉明 ( 一种已知可通过靶向成纤维细胞生长因子和血管内皮生长因子 ( VEGF ) 受体信号传导抑制血管生成的化合物 ) 用作阳性对照。通过自动分割从 3D 堆叠投影的荧光图像,可以显示和量化管状和节状结构 ( 图 4 )。统计分析表明,如总管长所示,苏拉明以浓度依赖性方式显著抑制了管的形成 ( Z'因子为 0.75 ) ( 图 5 )。 这些结果与使用明场成像和手动定量进行的结果相当,但是对于 96 孔板,测定时间从 8 小时大大减少到不到 30 分钟。
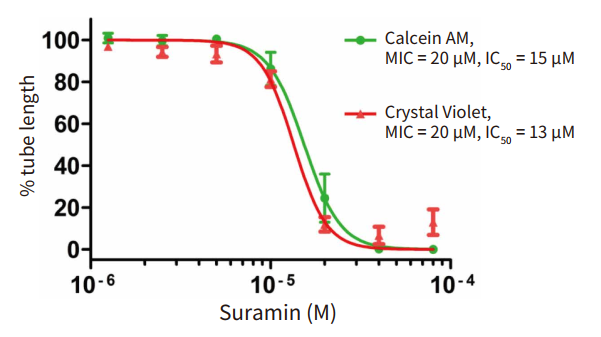
图 5 用苏拉明处理的管长百分比的浓度响应曲线。 用 MetaXpress 软件中的自定义模块测量用 Calcein-AM( 绿点 ) 或 Crystal Violet ( 红色三角形 ) 染色的HUVEC 管。用 4 参数曲线拟合绘制总管长百分数与苏拉明浓度的关系图,得出Calcein-AM 的 EC50 值为 15 µM,结晶紫的 EC50 值为 13 µM。 MIC ≥ 30%被评为显著反应。 图表显示三个或四个独立实验的平均值 ± SEM,两个重
结论
高通量筛选可实现多种管状结构形成应用
血管形成实验可作为一种体外 3D 血管生成工具,用于选择各种不同来源的内皮细胞、不同细胞类型的共培养、生长培养基的替代补充剂、不同类型的支持基质或对干细胞进行血管生成诱导等实验6,8-10。然而,从图像采集到处理和分析,扩大血管形成实验的规模面临巨大的挑战。在这里,我们总结了一种优化的 HUVEC 血管形成高通量定量分析,用于筛选抗血管生成化合物。通过荧光染色、z 层堆叠获取、整孔图像二维投影生成,以及采用独特的图像处理方法来定义小管和节点的自定义模块,我们能够为管状网络提供可靠的自动分析。通过自动化成像和分析,避免了分析结果的偏差,彻底解决了人工或半自动定量耗时的问题。使用 ImageXpress Micro Confocal 系统可以简化程序,并使血管分析可靠,可重现且通量高。
相关产品
全部评论(0条)
推荐方案
相关解决方案
参与评论
登录后参与评论