
立即扫码咨询
联系方式:400 820 3586
联系我们时请说明在仪器网(www.yiqi.com)上看到的!
介绍
生物研究和药物发现越来越需要扩大基于细胞的检测方法的多样性和复杂性。活细胞检测可以实时监测细胞反应,并提供关于化合物治疗效果和生物复杂性的重要见解。我们使用 ImageXpress Pico 自动细胞成像系统进行实时定量细胞成像分析,以监测细胞模型中anticancer化合物的复杂效果。
为了描述anticancer化合物的作用,我们监测了HeLa 宫颈癌细胞增殖和细胞周期的时间依赖效应。环境控制 (EC) 室用于提供所需的CO2 和 O2 浓度。采用透射光延时成像技术对细胞数量、融合度、细胞面积进行量化,采用荧光标记技术评价化合物处理对细胞周期的影响。
使用 ImageXpress Pico 系统结合 CellReporterXpress 成像采集和分析软件进行细胞检测。该成像设备提供五个荧光通道加上透射光 (brightfield) 以及比色成像。环境控制室和高精度自动移动台支持长时间、延时显微成像技术,可自动监测细胞增殖、分化、化合物毒性和各种其他基于细胞的检测。
方法
环境控制和延时监测
ImageXpress Pico 系统配备了一个环境控制室,可以控制和监控温度、CO2 和 O2 浓度以及湿度。与延时成像相结合,它提供了一个有效的工具进行现场实验,包括缺氧条件。
细胞培养
HeLa 细胞 ( 取自 ATCC ) 以每孔 3000 个细胞的密度培养在 384 孔黑色透明底微孔板 (Corning, #3663),在 37℃ 和 4% CO2的环境控制室中培养 24 小时。化合物处理24 小时,如图 1-4 所示。稳定表达组蛋白mCherry-H2B 和 Tubulin-GFP 的 HeLa细胞由 Málnási-Csizmadia 博士提供,并与正常 HeLa 细胞进行类似的培养和处理。
优势
• 通过环境控制和延时成像进行活细胞实验
• 实时监测细胞分裂及化合物效应评估
• 轻松导出延时数据到 MP4 格式,并保存为视频
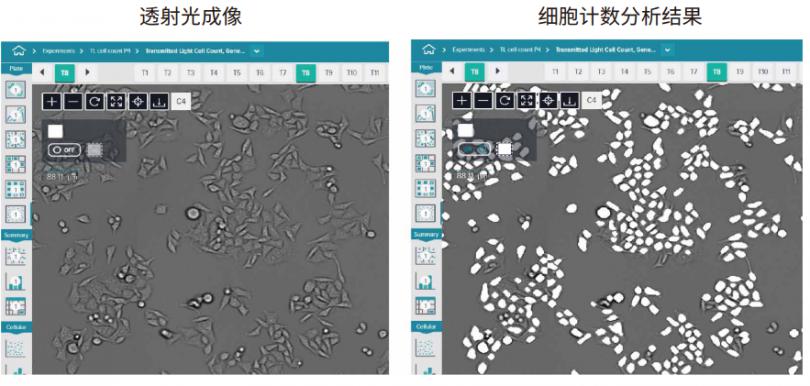
图 1 利用透射光照明,用 10X 物镜拍摄 HeLa 细胞的图像。 细胞计数的分析掩模显示为白色叠加( 占整个图像的 20% )。重要的是由于分析 protocol 无法修改或调整,因此在图像采集过程中需要对 protocol 进行优化。通常曝光时间在 1-6 毫秒范围内,而对焦偏移量通常为 -8。
细胞成像
为了使细胞成像结果可视化,并监测细胞增殖和细胞死亡,在 24 小时内,每隔 1 至2 小时用透射光 10X 物镜获取图像。在图像采集过程中使用透射光细胞计数通用分析 protoco (Transmitted light cell countgeneral analysis) 进行图像分析。分析提供了细胞数量、平均细胞面积和总细胞覆盖面积的测量。
结果
利用透射光细胞计数评估化合物对细胞活力和增殖的影响
通过获取延时图像,监测细胞培养的表型变化。用透射光或荧光标记物在 EC 室中对细胞进行 24 小时以上的监测。将细胞分别铺到 96 孔或 384 孔板中,每孔分别为12,000 细胞或 3,000 细胞。使用 10X 物镜,每隔一至两小时采集一次透射光图像,连续 24 小时,96 孔板中每孔成像 4个位点, 384 孔板中每孔成像 1 个位点。在图像采集过程中进行自动图像分析。图像分析包括在透射光下寻找细胞,计数细胞数量、单个细胞面积、细胞覆盖面积 ( 图1 )。根据大小和形状识别死亡细胞,以区分出健康细胞的分析。用绘图工具观察细胞增殖的动力学曲线。图 2 显示了 96 孔板中每孔细胞数随时间的增加,以此作为增殖的指示。
利用透射光成像和分析方法对anticancer化合物的作用时间进行了评价。通过连续 24 小时每两小时采集一次活细胞图像,观察化合物效应对细胞增殖的影响。观察星孢菌素和丝裂霉素 C 对细胞增殖的抑制作用呈剂量依赖性 ( 图 3 )。为了表征化合物效应,利用 SoftMaxPro 软件中的 4 参数曲线拟合算法计算出抑制细胞增殖 ( 细胞数量减少 ) 的化合物 EC50 值 ( 图 3B )。
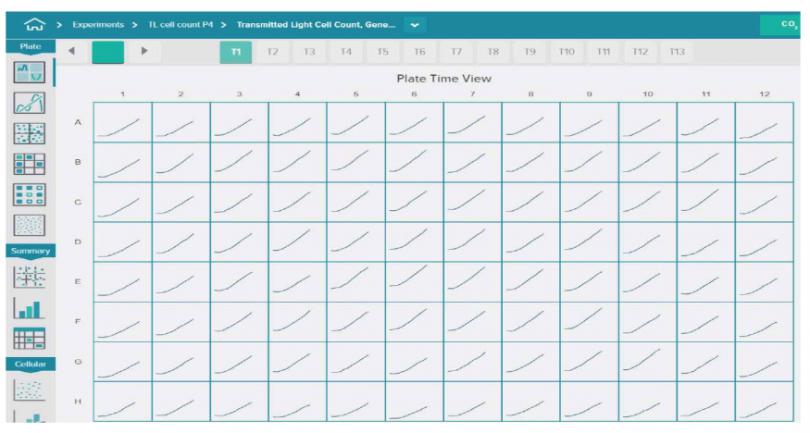
图 2 在 24 小时内实时监测细胞增殖和化合物效应。 细胞培养在 96 孔或 384 孔板中,并放置在 EC室。利用 10X 物镜,每 1-2 小时采集透射光图像,96 孔板每孔 4 个视野,384 孔板每孔 1 个视野。在采集过程中进行自动图像分析。注意当使用 IX-Pico 环境控制室时没有边缘效应
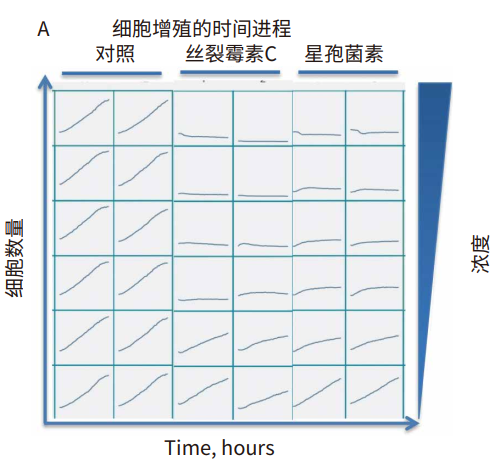
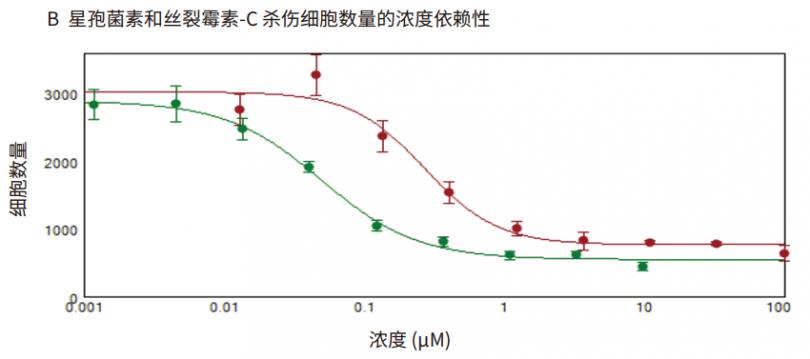
图 3 细胞增殖和细胞数量浓度依赖性变化的时间进程。(A) 时间进程数据可视化显示了对照孔和用增加的指示化合物浓度 ( 重复孔 ) 处理的孔的细胞计数。 (B) 24 小时浓度依赖性检测结果:丝裂霉素C (红色;IC50 0.27 μM), 以及 星孢菌素 ( 绿色;IC50 0.05 μM )
利用荧光标记实时识别有丝分裂细胞
我们监测了稳定表达组蛋白 mCherry‒H2B和 Tubulin-GFP 的 HeLa 细胞的分裂。通过使用荧光标记的组蛋白和细胞骨架蛋白,可以跟踪单个细胞在细胞周期中的进展。图4显示了 5 个细胞,每个细胞在 12小时内分裂。细胞间桥和形成的纺锤体是可见的 ( 白色箭头 )。核小而明亮的有丝分裂细胞可以通过图像分析来识别。计数所有细胞核 ( H2B-mCherry ) 和 GFP 染色面积 (tubulin) 也可以监测细胞总数和细胞扩散 ( 图 4B )。
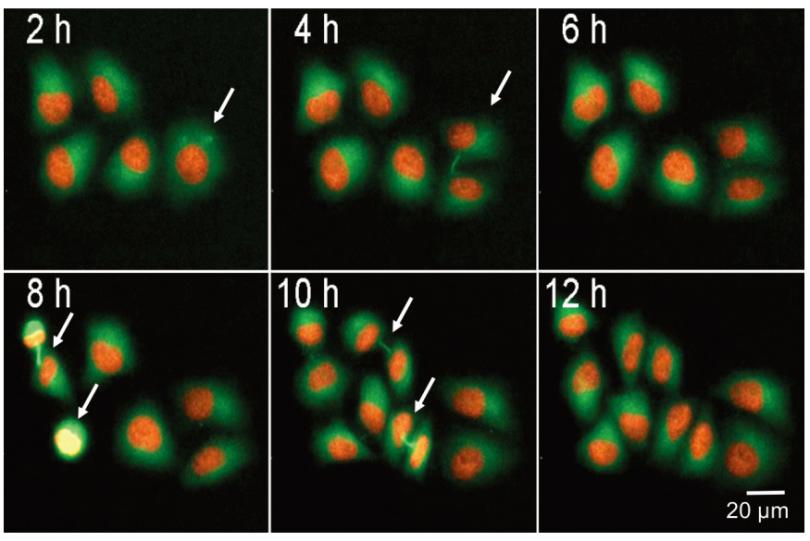
图 4 有丝分裂细胞的活细胞检测。 图像系列显示 HeLa 细胞稳定表达 mCherry-H2B, Tubulin-GFP,正在进行细胞分裂。用箭头表示有丝分裂细胞,在 10X 物镜、FITC 和 TRITC 光照下,每 2 小时采集一次图像,持续 25 小时。通过计算有丝分裂细胞总数与有丝分裂细胞数的比值,可以计算出有丝分裂细胞的百分比(%)
结论
总的来说,我们的研究结果证明了环境控制室和活细胞延时成像技术可以用于实时监测细胞分裂和评估化合物效应。在实验过程中,On the fly 即时分析的图像分析提供了细胞培养和细胞表型变化的自动监测。Z后延时数据可以很容易地导出为MP4 格式,并保存为视频。
相关产品
全部评论(0条)
推荐方案
相关解决方案
参与评论
登录后参与评论