| 行业应用: | 制药/化妆品 生物制药 |
简介
巨噬细胞起源于血液单核细胞,它们离开血液循环,穿透各种组织,在那里分化成巨噬细胞。它们参与清除病原体和吞噬死亡细胞。此外,它们通过释放细胞因子来引发炎症反应,这些细胞因子激huoxue管细胞,促进巨噬细胞粘附到血管并迁移到组织中。分化的 THP-1 细胞作为巨噬细胞的体外模型被广泛应用于巨噬细胞参与炎症反应的研究。人单核细胞 THP-1 可被佛波醇 12-肉豆蔻酸 13-乙酸酯 (PMA) 诱导分化为巨噬细胞,并被细菌脂多糖 (LPS) 激活。活化的 THP-1 细胞改变形态并变得更加粘附。它们还会分泌炎症细胞因子,这是 LPS 引发的细胞信号事件级联的结果。细胞因子的表达水平是细胞炎症模型的重要生理指标。在本文中,我们展示基于 THP-1 细胞的多参数测定试验的结果。 我们在 ImageXpress Pico 自动细胞成像系统上使用表型成像来评估细胞形态和粘附性。 我们还使用在 Pu·MA 系统上运行的低容量酶联免疫吸附试验 (ELISAs),并在 SpectraMax iD5 多功能微孔板读板机上检测,以测量分泌的细胞因子并评估化合物对炎症反应的影响。多参数的检测工作流程如图 1 所示。
优势
• 对珍贵样品进行多重参数分析
• 试剂用量减少 5-10 倍,3 小时内获得检测结果
• 自动成像观察巨噬细胞分化

我们观察到 THP-1 细胞经 PMA 和 LPS 的联合刺激,白细胞介素-8 (IL-8)、白细胞介素1β (IL-1β) 和肿瘤坏死因子-α (TNFα) 分泌水平增加。为了评估抗炎化合物的作用,另外用 p38 MAP 激酶 (MAPK) 抑制剂SB202190、吡咯烷二硫代氨基甲酸酯 (PDTC)及抗生素莫西沙星处理细胞。SB202190作用于 JAK / STAT 和 NFκB 途径。抗氧化剂 PDTC 抑制 NFκB 的活化。莫西沙星通过抑制 NF-κB,ERK 和 JNK 活化来抑制IL-8 和 TNFα 的分泌。通过量化细胞粘附力、细胞因子及趋化因子分泌的变化来评价化合物的抗炎作用。所选的化合物导致它们的分泌量呈浓度依赖性下降。对细胞形态和黏附力的影响也通过细胞图像的表型分析来评估。
材料
• THP-1 细胞 (ATCC)
• PMA (Sigma)
• LPS (Sigma)
• SB202190 (Sigma)
• PDTC (Sigma)
• 莫西沙星 (Sigma)
• IL-8,IL-1β 和 TNFα 的 ELISA 抗体对(BioLegend)
• ImageXpress Pico 自动细胞成像系统(Molecular Devices)
• Pu·MA系统 ( 蛋白质流体学 )
• SpectraMax iD5 多功能微孔板读板机(Molecular Devices)
方法
• 将 THP-1 细胞以每孔 20,000 个细胞接种于 96 孔微孔板,并孵育 48 小时。 然后用 PMA 和 LPS ( 0-5 pg / mL PMA 和0-100 pg / mL LPS ) 的混合物刺激它们24 小时。
• 刺激前两小时加入抗炎化合物。
• 孵育后,从每个孔中取出 60 μL 上清液用于 ELISA。样品可立即进行检测分析也可储存在 -70℃ 下用于后续分析。
• 上清液在检测缓冲液中以 3: 1 稀释,并使用 Pu·MA 系统流动芯片和试剂分析 IL-8,TNFα 和 IL-1β,随后使用SpectraMax iD5 读板机的吸光度模式检测结果。
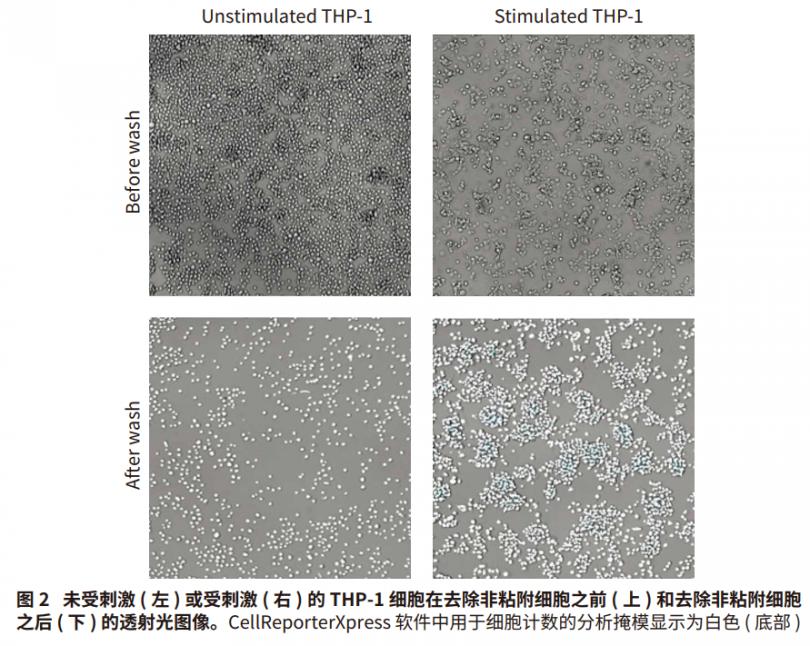
• 使用 ImageXpress Pico 成像系统的透射光 (TL) 成像细胞。 通过用培养基洗涤两次去除非粘附细胞,在CellReporterXpressTM 图像采集和分析软件中计数透射光图像中的细胞。
结果
在用 PMA 和 LPS 刺激后,活化的 THP-1细胞粘附于平板表面并上调细胞因子。 使用 ImageXpress Pico 系统使用透射光对细胞成像,以比较刺激前后的细胞形态。由 THP-1 细胞受刺激引起的细胞表型变化显示在图 2 中。细胞形态由单核细胞典型的小、圆、不粘附表型转变为更大、更平、更粘附的巨噬细胞表型。用 ImageXpress Pico 系统和 CellReporterXpress 软件对洗去非粘附细胞后出现的粘附细胞数量进行量化。
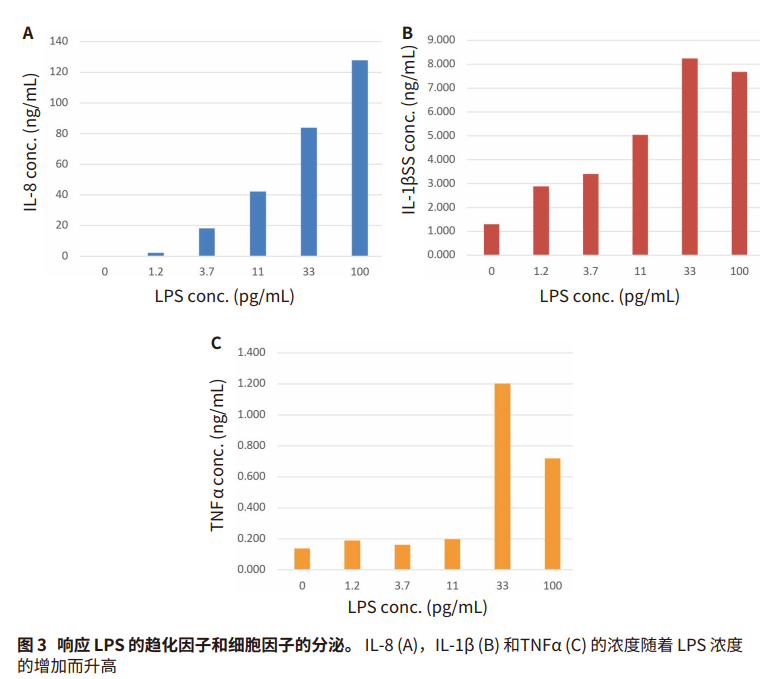
低体积的 Pu·MA 自动检测系统测量上清液中响应细胞刺激而分泌的趋化因子 IL-8和细胞因子 IL-1β 和 TNFα 的浓度。该检测系统采用低体积 (10-20 μL) 的上样量和现有的抗体对, 这便于我们测量样品体积有限的多种分析物。 细胞刺激引起的趋化因子和细胞因子分泌增加如图 3 所示。与未刺激的细胞相比,IL-8 的水平增加 30倍, IL-1β 增加 6 倍,TNFα 在刺激的细胞中增加 15 倍。
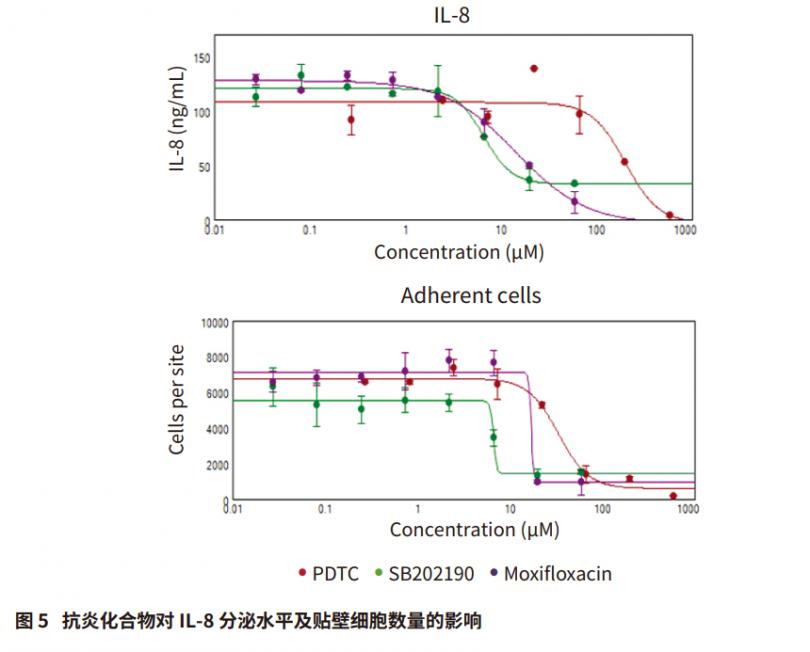
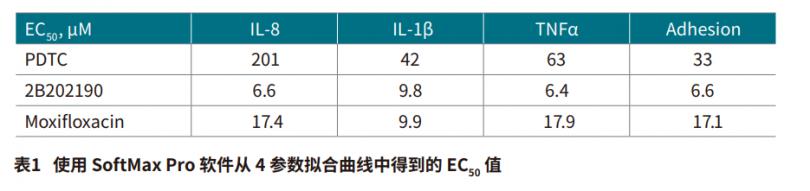
我们观察到几种抗炎化合物对受刺激的THP-1 细胞的细胞形态,粘附和 IL-8 分泌的影响。 使用 ImageXpress Pico 成像系统对由抗炎化合物引起的细胞形态的变化进行成像 ( 图 4 ) 。为了评价抗炎反应中细胞粘附的变化,我们通过图像分析确定洗涤之前和之后存在的贴壁细胞的数量。使用 CellReporterXpress 软件对图像中的细胞进行计数,将数据导入 SoftMax Pro 软件,通过 4 参数曲线拟合计算出 EC50 值。然后用 Pu·MA 系统和 SpectraMax iD5 读板机检测来自这些细胞的上清液,以确定抗炎化合物对趋化因子 IL-8 分泌的影响。经 SB202190、PDTC 和莫西沙星处理后,细胞中 IL-8 分泌量呈浓度依赖性下降,并导致粘附细胞数量减少 ( 图 5 )。 使用 4-参数曲线拟合计算得出的 EC50 值显示在表 1中。

结论
我们展现了一种多重参数的炎症检测方法,该方法采用 THP-1 炎症细胞模型,联合使用 ImageXpress Pico 自动细胞成像系统、Pu·MA 新型低体积自动 ELISA 检测系统和SpectraMax iD5 多功能读板机进行测定。ImageXpress Pico 系统对处理过的细胞进行透射光成像,随后 CellReporterXpress软件对响应刺激而粘附的细胞进行计数。Pu·MA 系统使用微流控芯片和 ELISA 抗体对技术进行免疫分析,该微流控芯片可将试剂使用量减少 5-10 倍,且在不到 3 小时内提供结果。在 SpectraMax iD5 读板机上检测 ELISA 结果,并使用 SoftMax Pro软件分析数据。使用以上的工作流程,我们同时监测了响应三种抗炎化合物的趋化因子和细胞因子( IL-8,IL-1β 和 TNFα )表达水平。 观测到的趋化因子和细胞因子水平的差异与已发表的作用机制一致。


美谷分子仪器(上海)有限公司
仪器网(yiqi.com)--仪器行业网络宣传传媒