川丁特罗贴剂的设计及分子机制研究

摘要:
目的 采用离子对与促透剂联合应用的促透策略,设计一种经皮透过性良好的川丁特罗贴剂,用于支气管哮喘的治 疗。
方法 首先采用有机溶媒挥散法制备川丁特罗经皮吸收贴剂,以 Wistar 大鼠皮肤为模型,采用单因素考察法在体 外经皮透过试验中考察离子对与促透剂的联用对川丁特罗经皮透过行为的影响并优选贴剂处 方。通过贴剂体外释放试验 和红外光谱试验,探讨离子对及促透剂对川丁特罗经皮透过行为的影响及分子机制。
结果 贴剂的优选处 方为川丁特罗对氨基苯甲酸为主药,载药量为 5%,DURO-TAK®87-4098 为压敏胶基质,8%聚甘油油酸酯为促透剂。离子对的形成增加 了川丁特罗的皮肤渗透性,而聚甘油油酸酯的加入对川丁特罗从贴剂中的释放和川丁特罗皮肤透过均有促进作用,2个技术 的联用增加了川丁特罗的皮肤累积透过量。
结论 本研究通过采用离子对与促透剂联合应用的策略,成功设计了川丁特罗压敏胶分散型贴剂,并从释放和经皮吸收2方面探讨了离子对和促透剂的作用机制,为开发川丁特罗贴剂提供参考。
关键词:川丁特罗;贴剂;离子对;促透剂;释放
作者简介:刘超,男,博士,副教授
支气管哮喘简称哮喘,是由多种细胞及细胞组分参与的一种常见的慢性气道炎症性疾病,主要症状为反复发作的喘息、气急、胸闷或咳嗽,多在夜间及凌晨发作或加重[1]。该病在各年龄段均 可发病,其中老年人的发病率Z 高[2]。近年来,随着工业化程度的提高,大气污染的加重和化工业的发展,哮喘的发病率逐渐增加。
川丁特罗是一种新型长效高选择性 β2-肾上腺素受体激动剂,用于哮喘的治 疗[3] ,通过AC-cAMP-PKA 途径显著扩张气道平滑肌,稳定肥 大细胞,增强气道纤毛运动能力,从而发挥抗哮喘作用[4]。川丁特罗具有剂量小、作用时间长、专属性强、可控制夜间发作等特点,是一个非常有发展潜力的新药。目前川丁特罗仅有片剂和气雾剂相关研究。而经皮吸收贴剂与片剂、气雾剂 2 种剂型相比,使用方便,不需要多次给药,避免肝脏的首过效应和药物对胃肠道的不良反应,符 合时辰治 疗学理念,具有更高的安全性和患者依从性[5]。而且,同类产品妥洛特罗经皮吸收贴剂取得成功,表明经皮吸收贴剂这种给药形式适合于此类疾病的治 疗。因此开发一种使用方便,经皮透过行为良好的川丁特罗经皮吸收贴剂具有重要意义。川丁特罗的化学结构见图 1,其相对分子质量为310.5Da,日剂量低(100~200 μg·d−1),油水分配系数 log KO/W 为1.71,为亲脂性药物,经测定盐酸川丁特罗熔点为 230 ℃,川丁特罗游离碱 熔点为93℃,因此游离碱更适合经皮给药,在预试验中发现川丁特罗游离碱的经皮透过量并未达 到预期目标,因此需要采取有效的策略以提高川丁特罗游离碱的经皮渗透能力。
离子对是指带有相反电荷的 2 个离子不通过共价键结合成的一对离子[6]。弱酸或弱碱性药物通过与反离子形成离子对,可提高其经皮渗透性,此方法已被成功应用于多种药物的经皮给药制剂 研究中[7]。离子对技术作为一种简单而有效的方法,可双向调节经皮给药制剂中药物的经皮渗透行为。一方面,对于皮肤通透性较差的药物,形成离子对复合物可以增加其经皮透过能力,从而提高贴剂的递送效率。另一方面,对于皮肤渗透性过高的药物,可通过形成离子对复合物降低其 经皮透过性,为制备长效贴剂提供基础[8]。结合川 丁特罗游离碱弱碱性(pKa=7.91±0.02)的性质,考虑引入有机酸,使有机酸与川丁特罗结合形成川丁特罗-有机酸离子对复合物,从而提高川丁特罗的经皮透过能力。而化学促透剂作为一种有效的促进药 物经皮吸收的策略也被广泛应用。因此,为了Z 大程度地提高川丁特罗的经皮透过性,考虑将离子对 技术与化学促透剂联合应用开发川丁特罗贴剂。
1 材料
盐酸川丁特罗和川丁特罗游离碱由沈阳药科大学程卯生教授实验室提供,纯度≥98%;对氨基苯甲酸、苯甲酸、油酸、水杨酸、乙酸乙酯和吐温80购自天津市博迪化工有限公司;肉豆蔻酸和磷酸二氢钾(色谱纯)购自上海阿拉丁试剂有限公司;压敏胶 DURO-TAK® 87-2510(货号:DT-2510)、 DURO- TAK® 87-4098( 货号:DT-4098) 、 DURO-TAK® 87-2852(货号:DT-2852)购自德国汉高公司;防黏层和背衬层CoTran™ 9733 购自美国3M 公司;聚甘油油酸酯(Plurol® Oleique CC 497,POCC)和二乙二醇单乙基醚(Transcutol® P)购自嘉 法狮(上海)贸易有限公司;氮酮(天门科捷制药有限 公司);薄荷醇(安徽太岛薄荷药业有限公司);丙二醇(南京化学试剂有限公司);甘油、磷酸二氢钾 (分析纯)和氢氧化钠购自天津市恒兴化学试剂制 造有限公司;辛癸酸甘油酯(ODO,河南聚荣食品 添加剂有限公司);乙腈(色谱纯,天津市康科德科 技有限公司);实验中所用水均为实验室自制重蒸 水;其余试剂均为分析纯;赛璐玢膜(浙江省上虞 市玻璃纸有限公司)。
AL-104 电子天平、FE20 型实验室 pH 计和 DZF 型真空干燥箱购自北京永光明医疗仪器有限 公司;EYELA®N1000 型旋转蒸发仪(上海爱郎仪 器有限公司);SZ-96 自动纯水蒸馏器(上海雅荣生 化仪器厂);高效液相色谱系统 L-2130 泵和 L-2420 可变波长紫外吸收检测器购自日本日立公司;HT-220A 色谱柱恒温箱(大连汇达科学仪器有限公 司);Diamonsil C18 色谱柱(200 mm×4.6 mm,5 μm) 购自迪马科技公司;科德士宠物用电推剪(深圳科德士电子厂);CJJ-6 六联磁力加热搅拌器(上海君 竺仪器有限公司);TB-1 型实验用框式涂布器(上 海锴凯科技贸易有限公司);Logan SYSTEM 918-12 型全自动透皮仪[禄亘仪器设备(上海)有限公司];Xiang Yi H-2050R 高速台式冷冻离心机(湖 南湘仪实验室仪器开发有限公司);Bruker® IFS-55 型红外光谱仪 ( 德 国 Bruker公司 ) ;DSC1 STAReSystem 差示扫描量热仪(瑞士梅特勒-托利 多公司)。
SPF级Wistar大鼠,♂,体质量180~220g, 由沈阳药科大学实验动物中心提供,伦理许可号:SYPU-IACUC-2020-1-3-202。实验用动物的饲养 与试验操作均获得沈阳药科大学实验动物伦理 委员会批准,并严格按照要求进行试验。所有动物均按常规饲养,自由摄取饲料和水。
2 方法
2.1 川丁特罗分析方法
采用 HPLC 进行样品分析,川丁特罗色谱条件如下:Diamonsil C18 色谱柱(200 mm× 4.6 mm,5 μm);每 1000mL流动相为乙腈-水(250︰750) 并添加0.51g磷酸二氢钾和375 μL 磷酸;检测波长为246 nm;柱温为 40℃;流速为1mL·min−1;进样量为20μL。
2.2 川丁特罗-有机酸离子对的制备
分别将等摩尔量的川丁特罗游离碱和有机酸溶解于丙酮中,磁力搅拌2h,于45℃水浴下用旋转蒸发仪除去丙酮,于25℃真空干燥12h 后,得川丁特罗-有机酸离子对复合物。
2.3 贴剂的制备
采用有机溶媒挥散法制备川丁特罗的压敏胶分散型贴剂。称取处 方量的川丁特罗或其离子对复合物,加入处 方量乙酸乙酯,待药物完全溶解后, 加入处 方量的化学促透剂,待其溶解后,再加入处 方量的压敏胶,常温下磁力搅拌2h,静置 15min脱气泡,使用0.40 mm涂布器在防黏层上均匀涂布上述混合溶液,室温下放置10min后再于50℃烘箱中烘干 10min,待有机溶剂挥发后取出,覆盖背衬层,冲切得川丁特罗压敏胶分散型贴剂。
2.4 离体鼠皮的制备
在大鼠腹腔注射20%乌拉坦溶液进行麻醉,用宠物修剪器剃除大鼠腹部的长毛,再用剃须刀除去其腹部残留的鼠毛。随后将处于麻醉状态的大鼠脱颈椎处死,立即用手术剪取下腹部皮肤,并剔除皮下脂肪及其他组织后,用显微镜检查皮肤的完整性,舍弃损伤皮肤。将离体皮肤用生理 盐水冲洗干净,裁剪成适当的尺寸,密封于铝箔袋中,在−70 ℃条件下冷冻保存备用,使用期限为1个月。
2.5 体外经皮透过试验
采用卧式双室扩散池(直径为1.2 cm,有效面积为1.13 cm2 )考察川丁特罗贴剂的体外经皮透过行为。将面积为1.13cm2川丁特罗贴剂贴于离体鼠皮的角质层一侧,并使角质层朝外,真 皮层朝向接收液,放入转子并向扩散池中加入3.5mL接收介质磷酸盐缓冲(PBS,pH 7.4),在 32 ℃、转速为500 r·min−1的条件下恒速搅拌。分别于 2,4,6,8,10,12,24 h 从接收池中取样2.0mL,并向其中补加相同体积的空白接收液以保持漏槽条件。样品于16 000 r·min−1低温离心5min 后,取上清液, 样品进液相分析得到药物浓度。体外经皮给药试验中 n=3,药物累积透过量Q的计算如公式(1)所示:
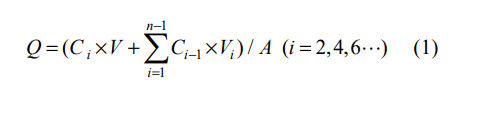
其中 Q(μg·cm−2)为单位面积药物累积透过量;Ci(μg·mL−1)和 Ci–1(μg·mL−1)分别为第 i 次和第 i–1次取样时接收介质中的药物浓度;V(mL)为接收介 质的体积;Vi为每次取样的体积(2.0 mL);A(cm2 ) 为药物有效渗透面积(1.13 cm2 )。将单位面积药物累积透过量(Q)对时间(t,h)作图,得到药物的体外经皮渗透曲线。统计分析方法为单因素方差分析 (ANOVA)和 t 检验,以 P<0.05表示差异具有统计 学意义。
2.6 贴剂体外释放试验
利用体外释放试验考察处 方因素对药物从贴剂中释放行为的影响。实验装置与体外经皮透过 试验相同,其中的鼠皮用赛璐玢膜代替,分别于 0.5,1,2,3,4,6,8,10,12,24h 从接收池中取样2mL,并向其中补加相同体积的空白接收液,并将样品进液相分析,计算贴剂的释放率。
2.7 红外光谱法
本实验采用傅里叶红外光谱(Fourier transform infrared spectrometer,FTIR)确认川丁特罗-有机酸离子对的形成。将有机酸以及川丁特罗-有机酸离 子对分别溶解在乙酸乙酯中,配制成 1.0 mg·mL−1 的溶液(按照药物浓度计算)。各取25μL滴加在 KBr 片上,待溶剂挥发后,在4000~ 400 cm−1 内进行测定,获得红外光谱图。
采用傅里叶变换衰减全反射光谱法 (attenuated total reflection-FTIR,ATR-FTIR)考察离子对及促透剂聚甘油油酸酯对皮肤角质层屏障功能的影响。供给液的选择如下:对照组选用空白ODO溶液;实验组选用川丁特罗、川丁特罗-对氨 基苯甲酸、川丁特罗-对氨基苯甲酸-聚甘油油酸酯和聚甘油油酸酯的ODO 溶液。利用立式扩散池, 将离体鼠皮的真 皮侧朝向接收池,取上述供给液 各 200 μL 分别加于供给池中的角质层表面,接收液为 pH 7.4的PBS 溶液,进行透皮试验。2h后取下皮肤,用脱脂棉将皮肤表面擦拭干净后进行测定。衰减全反射附件中发生全反射的晶体材料为硒化锌, 入射光角度为 45°,扫描次数为 32 次。
采用 FTIR 研究川丁特罗-对氨基苯甲酸和聚甘油油酸酯与压敏胶(货号:DT-4098)之间的分子间相互作用,探讨促透剂对药物从贴剂中释放行为的影响。分别制备纯压敏胶贴剂,以压敏胶为基质的川丁特罗-对氨基苯甲酸贴剂、川丁特罗对氨基苯甲酸-聚甘油油酸酯贴剂和聚甘油油酸 酯贴剂。精密称取上述贴剂胶层约 20 mg,分别置于 2.0mL EP 管中,准确加入 1.0 mL 乙酸乙酯, 完全溶解后,准确量取25.0μL分别滴加到空白KBr 片上,待溶剂挥干后,采用 Bruker®IFS-55 型红外光谱仪在4 000~400 cm–1波数范围进行扫描。
3 结果
3.1 川丁特罗-有机酸离子对形成的表征
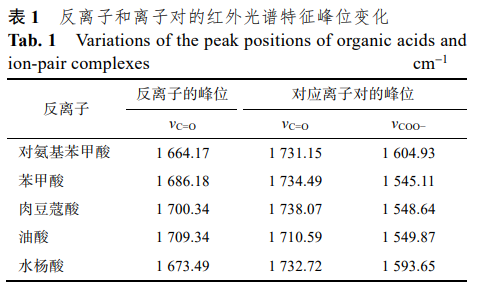
利用红外光谱法表征了川丁特罗离子对的形成,结果显示,5种有机酸在未形成离子对时在1740~1650cm–1处都有一个羰基的伸缩振动峰 (νC=O),当与川丁特罗游离碱形成离子对复合物后, 该峰位向高波数移动,并且在 1540~1610 cm–1 处出现新的羧酸盐的伸缩振动峰(νCOO−),表明形成了川丁特罗-有机酸离子对。结果见表 1。
3.2 压敏胶的筛选
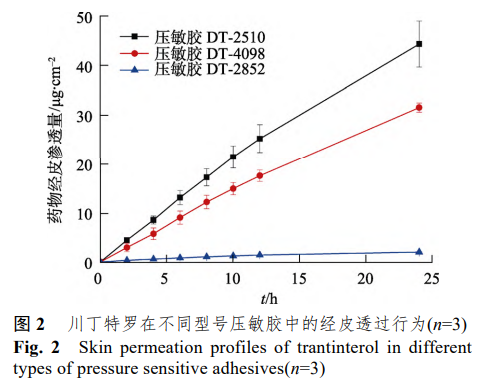
压敏胶是透皮贴剂的关键辅料之一[9],它可以使贴剂与皮肤表面紧密贴合,作为药物储库递送药物[10]。压敏胶除了会影响贴剂的黏附性,还会影响贴剂中药物的透过量等[11-12]。本实验以 2%的载药量考察了 3 种含有不同官能团的聚丙烯酸酯型压敏胶对川丁特罗经皮透过行为的影响。结果显示,川丁特罗在含有羟基官能团的DT-2510压敏胶中透过量Z 高,其次是无官能团的 DT-4098,而在含羧基官能团的DT-2852中透过量Z 少。由于以DT-2510为基质时贴剂压敏胶层 的内聚力较差,综合考虑贴剂的皮肤黏附性能和药 物透过量,选择DT-4098(DURO-TAK®87-4098)作为压敏胶基质进行后续研究。结果见图 2。药物在DT-4098 中的溶解度>5%,因此,后续试验将载药量提高至 5%。
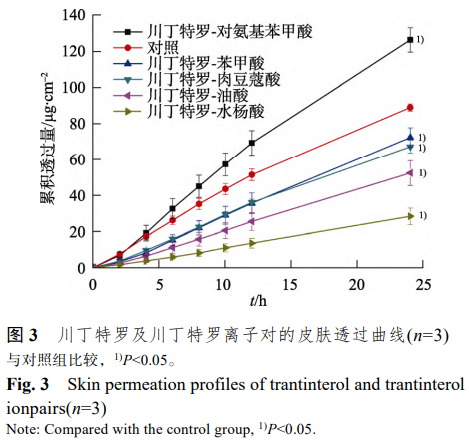
3.3 离子对的筛选
为了进一步提高川丁特罗的累积透过量,从而提高贴剂的利用率,并减少给药面积,本实验采用离子对技术,考察了以DT-4098 型压敏胶为贴剂基质,5%载药量下川丁特罗及其离子对复合物贴剂的体外经皮透过行为。结果显示,只有当川丁特罗与对氨基苯甲酸形成离子对复合物后累积透过量显著增加,而其他 4 种离子对复合物在贴剂中的累积透过量都显著降低,因此选择透过性Z 佳的川丁特罗-对氨基苯甲酸离子对复合物进行后续研究。结果见图 3。
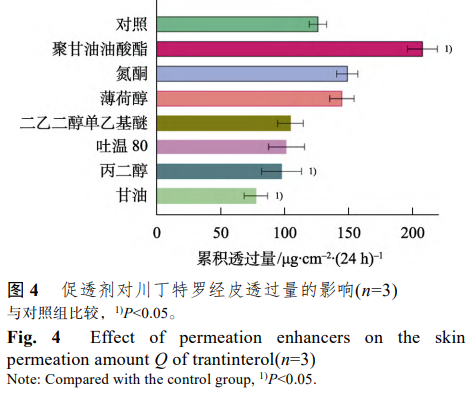
3.4 促透剂及含量的筛选
考察了7种促透剂(添加量 8%)对川丁特罗离子对经皮透过行为的影响,结果显示,聚甘油油酸酯对川丁特罗离子对有显著的促透作用,其余促透剂的促透作用不明显,甚至有抑 制作用,如甘油等。因此选择聚甘油油酸酯作为该贴剂的促透剂。结果见图 4。
3.5 皮肤的 ATR-FTIR 图谱
利用ATR-FTIR考察了离子对和促透剂对皮肤脂质排列行为(屏障功能)的影响。经川丁特罗、川丁特罗-对氨基苯甲酸、川丁特罗-对氨基苯甲酸-聚甘油油酸酯和聚甘油油酸酯处理的皮肤的ATR-FTIR图谱见图 5。
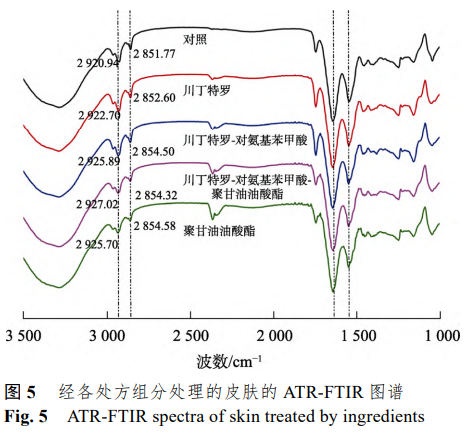
皮肤角质层脂质在波数 2800~3000cm–1内有强的亚甲基的对称伸缩振动峰(νsCH2 约为 2851cm–1) 和亚甲基不对称伸缩振动峰 (νasCH2 约为 2920 cm–1) [13-14]。角蛋白在波数 1500~1700cm–1 内有明显的酰胺 I 带(约1642 cm–1)与酰胺 II 带(约 1 546 cm–1)振动峰。
与对照组相比,用川丁特罗和川丁特罗-对氨 基苯甲酸处理皮肤之后,皮肤脂质的 νasCH2 和 νsCH2均有非常明显的位移(νasCH2 对 照=2 920.94 cm–1, νasCH2 川丁特罗 = 2 922.70 cm–1,νasCH2 川丁特罗-对氨基苯甲酸= 2 925.89 cm–1,νsCH2 对照=2 851.77 cm–1,νsCH2 川丁特罗= 2 852.60 cm–1,νsCH2 川丁特罗-对氨基苯甲酸=2 854.50 cm–1)。表明该离子对能够扰乱皮肤脂质排列。
加入聚甘油油酸酯后νasCH2 峰位发生进一步移动(νasCH2川丁特罗-对氨基苯甲酸-聚甘油油酸酯=2 927.02 cm–1,νsCH2 川丁特罗-对氨基苯甲酸-聚甘油油酸酯=2 854.32 cm–1)。同时, 经聚甘油油酸酯处理的皮肤的νasCH2和νsCH2 峰与 空白皮肤相比也发生明显的位移,都说明了聚甘 油油酸酯能够显著影响角质层脂质的排列从而增 加川丁特罗的透过性。
而离子对和促透剂的加入并没有使酰胺 I 带 (1 642 cm–1)和酰胺 II 带(1 546 cm–1)产生明显位移,说明二者并未和角蛋白的酰胺 I 带和酰胺 II 带发生明显的相互作用。因此川丁特罗-对氨基苯甲酸离子对与促透剂聚甘油油酸酯只和角质层的 脂质发生相互作用,扰乱脂质排列,从而增加川丁特罗的皮肤透过性。
3.6 体外释放试验
利用体外贴剂释放试验计算贴剂的透过-释放 比(Q/R)和贴剂释放率(R/C,C为贴剂中单位面积药物含量),以考察反离子和促透剂在经皮给药中发挥的作用。结果见表 2。
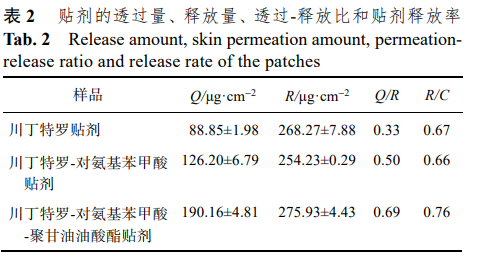
从透过-释放比(Q/R)的结果可以看出,3 种贴 剂的 Q/R 值均远<1,说明贴剂中药物经皮透过的 主要限速步骤仍为皮肤[15]。而 3 种贴剂的释放率 (R/C)值分别为 0.67,0.66,0.76,表明离子对的形 成(川丁特罗-对氨基苯甲酸贴剂)对药物从贴剂中 的释放过程几乎没有作用,而聚甘油油酸酯的加 入显著促进了药物从贴剂中的释放。
3.7 贴剂的 FTIR 图谱
为了进一步验证聚甘油油酸酯可以促进川丁特罗-对氨基苯甲酸从压敏胶中的释放,利用 FTIR研究了聚甘油油酸酯对药物与压敏胶聚合物的分 子间相互作用的影响[16]。各种贴剂的 FTIR 图谱见 图 6。
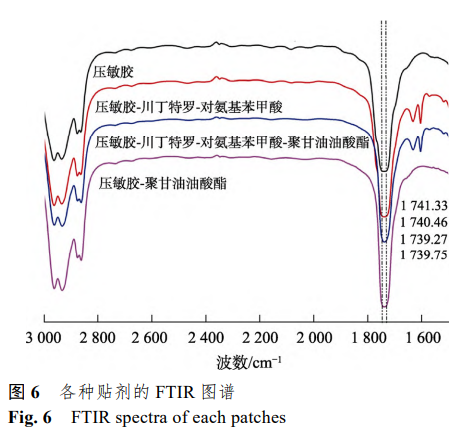
无官能团压敏胶的主要官能团是酯基,其强伸缩振动峰位于1770~1720cm–1。由实验结果可知,空白压敏胶的峰位在 1 741.33 cm–1,当在压敏胶中加入川丁特罗-对氨基苯甲酸后,峰位向低波数移至1740.46cm–1,这可能是由于压敏胶的酯基与川丁特罗-对氨基苯甲酸发生氢键相互作用;在压敏胶川丁特罗-对氨基苯甲酸贴剂的基础上加入聚甘油 油酸酯后,峰位继续向低波数移动至1739.27cm–1,而且在空白压敏胶中加入聚甘油油酸酯,峰位与空白压敏胶相比也向低波数移动,移至1739.75cm–1,这都表明了聚甘油油酸酯与压敏胶的酯基发生了氢键相互作用。与释放试验结果相结合,说明聚甘油油酸酯促进药物释放的原因可能是聚甘油油酸酯加入后竞争川丁特罗-对氨基苯甲酸与压敏胶之间的氢键作用位点,减弱了二者的相互作用,从而促进了川丁特罗的释放。
4 结论
本研究利用离子对联合促透剂技术设计了川丁特罗经皮给药贴剂。药物形成离子对并加入促透剂聚甘油油酸酯后显著增加了药物的经皮渗透性,提高了贴剂利用率。并利用红外光谱试验证明了川丁特罗-对氨基苯甲酸离子对和促透剂聚甘 油油酸酯都能够提高药物的皮肤渗透性,且聚甘油油酸酯凭借更强的氢键形成能力,能够争夺川丁特罗-对氨基苯甲酸离子对与压敏胶之间的氢键作用位点,减弱了离子对复合物与压敏胶的相互作用力,从而促进药物从压敏胶中的释放,Z 终增加了药物的皮肤透过量及贴剂的利用率。本研究为川丁特罗贴剂的开发提供了参考。
REFERENCES
[1] 中华医学会呼吸病学分会哮喘学组. 支气管哮喘防 治指南 (2020 年版)[J]. 中华结核和呼吸杂志, 2020, 43(12): 1023- 1048.
[2] 彭平. 支气管哮喘的发病机制及用药治 疗该病的研究进展 [J]. 当代医药论丛, 2018, 16(10): 34-35.
[3] WANG T T, SUN Y T, MA W X, et al. Trantinterol, a novel β2-adrenoceptor agonist, noncompetitively inhibits P-glycoprotein function in vitro and in vivo[J]. Mol Pharm, 2015, 12(1): 1-9.
[4] YANG W, GAN L N, WANG M W, et al. Genetic toxicity of tranterol hydrochloride[J]. Chin J New Drugs(中国新药杂志), 2006, 15(1): 22-25. [5] WIEDERSBERG S, GUY R H. Transdermal drug delivery: 30+ years of war and still fighting![J]. J Control Release, 2014(190): 150-156.
[6] GILLI P, PRETTO L, BERTOLASI V, et al. Predicting hydrogen-bond strengths from acid-base molecular properties. The pK(a) slide rule: Toward the solution of a long-lasting problem[J]. Acc Chem Res, 2009, 42(1): 33-44.
[7] CUI H X, QUAN P, ZHAO H Q, et al. Mechanism of ion-pair strategy in modulating skin permeability of zaltoprofen: Insight from molecular-level resolution based on molecular modeling and confocal laser scanning microscopy[J]. J Pharm Sci, 2015, 104(10): 3395-3403.
[8] ZHAO H Q, LIU C, QUAN P, et al. Mechanism study on ion-pair complexes controlling skin permeability: Effect of ion-pair dissociation in the viable epidermis on transdermal permeation of bisoprolol[J]. Int J Pharm, 2017, 532(1): 29-36.
[9] WANG W, SONG T, WAN X C, et al. Investigate the control release effect of ion-pair in the development of escitalopram transdermal patch using FT-IR spectroscopy, molecular modeling and thermal analysis[J]. Int J Pharm, 2017, 529(1/2): 391-400.
[10] TAN H S, PFISTER W R. Pressure-sensitive adhesives for transdermal drug delivery systems[J]. Pharm Sci Technol Today, 1999, 2(2): 60-69.
[11] LOBO S, SACHDEVA S, GOSWAMI T. Role of pressure-sensitive adhesives in transdermal drug delivery systems[J]. Ther Deliv, 2016, 7(1): 33-48.
[12] DIMAS D A, DALLAS P P, REKKAS D D, et al. Effect of several factors on the mechanical properties of pressure-sensitive adhesives used in transdermal therapeutic systems[J]. AAPS Pharm Sci Tech, 2000, 1(2): E16. Doi: 10.1208/pt010216.
[13] ZHANG C F, YANG Z L, LUO J B, et al. Effects of cinnamene enhancers on transdermal delivery of ligustrazine hydrochloride[J]. Eur J Pharm Biopharm, 2007, 67(2): 413-419.
[14] ZHANG C F, ZHAN W, YANG Z L, et al. Impacts of bicyclo-monoterpene enhancers on transdermal delivery of ligustrazine[J]. Acta Pharm Sin(药学学报) 2010, 45(11): 1452-1458.
[15] GUY R H, HADGRAFT J. Rate control in transdermal drug delivery?[J]. Int J Pharm, 1992, 82(3): R1-R6.
[16] FULE R, AMIN P. Hot melt extruded amorphous solid dispersion of posaconazole with improved bioavailability: Investigating drug-polymer miscibility with advanced characterisation[J]. Biomed Res Int, 2014(2014): 146781. Doi: 10.1155/2014/146781.
相关产品
全部评论(0条)
推荐阅读
-

- 电穿孔:对细胞膜通透性影响的分子机制研究
- 细胞膜通透性调节意义重大。电穿孔影响其通透性有复杂分子机制,涉及分子结构、蛋白质、信号传导、模拟、生物物理学、细胞生理响应等多层面,研究可为相关应用提供理论基础。
-

- 生物素标记PSTV互补DNA探针分子杂交机制研究
- 生物素标记马铃薯纺锤块茎类病毒(PSTVd)互补DNA探针,结合威尼德分子杂交仪等设备,系统分析了探针与靶标RNA的特异性结合机制。
-

- 基于酵母双杂交技术筛选hBex1相互作用蛋白的分子机制研究
- 酵母双杂交技术系统筛选与hBex1相互作用的蛋白,揭示其潜在分子调控网络。利用威尼德电穿孔仪构建诱饵载体并转化酵母菌株,结合文库筛选及威尼德紫外交联仪验证互作。
-

- 小鼠精子核内基因转染技术建立及其分子机制研究
- 通过优化电穿孔参数与精子预处理方法,成功建立了小鼠精子核内基因高效转染技术体系。
①本文由仪器网入驻的作者或注册的会员撰写并发布,观点仅代表作者本人,不代表仪器网立场。若内容侵犯到您的合法权益,请及时告诉,我们立即通知作者,并马上删除。
②凡本网注明"来源:仪器网"的所有作品,版权均属于仪器网,转载时须经本网同意,并请注明仪器网(www.yiqi.com)。
③本网转载并注明来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
④若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi












参与评论
登录后参与评论