沉默大脑神经元基因表达的siRNA脂质纳米颗粒递送
大脑中基因表达的操纵是理解神经元过程中蛋白质功能的基础。本文中,我们展示了一种使用脂质纳米颗粒(LNPs)中的小干扰RNA(siRNA)的方法,通过颅内注射在细胞培养和活体大脑中有效地沉默神经元基因表达。我们发现,神经元以一种载脂蛋白E依赖的方式积累这些LNPs,导致细胞培养中非常有效的摄取(100%),并且几乎没有明显的毒性。在活体内,皮质内或侧脑室(ICV)内siRNA-LNP注射导致靶基因在注射部位周围的离散区域或ICV注射后更广泛的区域被敲低,而LNPs没有明显的毒性或免疫反应。通过显示针对GRIN1(编码NMDA受体(NMDAR)的GluN1亚基)的皮质内siRNA传递,与突触AMPA受体电流相比,选择性地降低了活体内突触NMDAR电流,从而证明了有效的靶向敲低。因此,LNP递送的siRNA可以快速操纵体内神经元过程中涉及的蛋白质表达,可能使神经系统疾病的基因治疗得以发展。
自从发现RNA干扰是由双链RNA介导,使用小干扰RNA(siRNA)来沉默特定基因已成为一种强大的方法来操纵体外和体内的基因表达。然而,关于在体外和体内向神经元递送siRNA的问题限制了siRNA在哺乳动物神经科学研究中的广泛应用。短发夹RNA(shRNA)的病毒递送已经成功地在体内使用来敲低选择的目标,但必须考虑将shRNA包装成高滴度病毒的时间和费用,以及与病毒载体相关的毒理学和免疫学问题。在细胞培养中,由于使用脂质体技术观察到的低转染水平和毒性,使用siRNA方法在神经元中沉默基因仍然受到限制。转基因方法调节神经系统基因表达是耗时且昂贵的。反义寡核苷酸(ASOs)的稳定形式注射到大脑时可以有效,但需要注射大量的ASOs才能有效摄取。开发替代的递送方法,以促进siRNA在哺乳动物zhongshu神经系统中操纵基因表达,对神经科学家具有重要价值,并将加速我们对大脑功能的理解。
脂质纳米颗粒(LNPs)是目前外周细胞中siRNA治疗潜力的主要递送系统。在动物模型中,经过静脉注射(IV)的LNP-siRNA系统含有优化的阳离子脂质,可以沉默多种组织(特别是肝脏)5-7中的治疗相关基因。使用这些LNPs治疗心血管疾病、某些形式的淀粉样变和其他疾病的临床试验结果呈阳性(http://www.alnylam.com/Programs-and-Pipeline/Alnylam-5x15/index.php)。然而,LNP方法将siRNA递送至zhongshu神经系统神经元的疗效尚不清楚。由于LNP系统无法穿过血脑屏障,这些系统在脑组织中沉默基因的效力尚未被调查。在本文中,我们报告了在哪些条件下,LNP递送siRNA是一种非常有效的方法,可以在原代神经元培养和颅内注射后在体内沉默神经元基因表达。
在LNPs中封装siRNA
LNPs是通过使用微流控微混合器将适当体积的乙醇中脂质混合物与含有siRNA双链的水相混合而制备的(图1a)。所使用的脂质组成为3-(二甲基氨基)丙基(12Z,15Z)-3-[(9Z,12Z)-十八碳9,12-二烯-1-基]己二酸-12,15-二烯酸酯(DMAP-BLP)(结构见图1b)/二硬脂酰磷脂酰胆碱(DSPC)/胆固醇/PEG-DMG,摩尔百分比为50/10/37.5/1.5。LNPs还含有1 mol%荧光标记脂质DiOC18或DiIC18,以监测LNP摄取。先前的研究表明,具有这种脂质组成的LNP系统可以在静脉注射后以低至0.01mg siRNA/kg体重的剂量水平以载脂蛋白E(ApoE)依赖的方式沉默肝细胞中的靶基因。所产生的LNP磷酸酶和张力蛋白同源物1(PTEN)-siRNA系统直径为55±11nm(尺寸分布见图1c)。
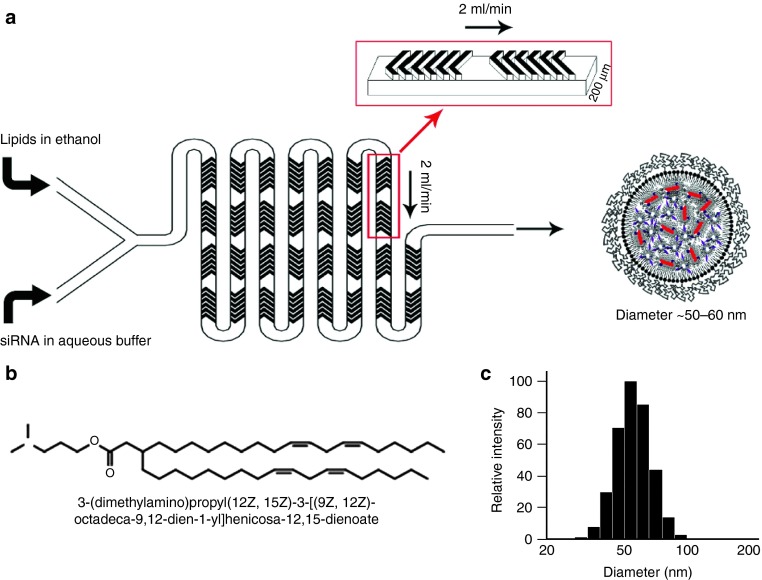
图1,采用交错人字形微搅拌器LNP-siRNA制备工艺示意图。(a)乙醇中的脂质混合物和水溶液中的siRNA分别被注射泵以总流量2 ml/min泵入微流体混合装置的两个入口。人字形结构诱导层流的混沌对流,导致乙醇和水相的快速混合,并相应地使脂质溶液的极性迅速增加。在临界极性下沉淀形成LNPs。混合通道的尺寸为200×79 μm,人字形结构为31 μm高和50 μm厚。根据参考文献修改。(b)可电离阳离子脂质-3-(二甲氨基)丙基(12Z,15Z)-3-[(9Z,12Z)-十八碳-9,12-二烯-1-基]己二酸-12,15-二烯酸酯(DMAP-BLP)的化学结构。(c)使用NICOMP 370亚微米颗粒分级仪在数字模式下分析LNPs(LNP PTEN-siRNA)的代表性粒径分布。LNP,脂质纳米颗粒;siRNA,小干扰RNA。
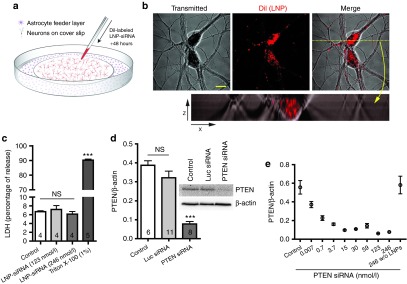
图2,LNP-siRNA系统介导神经元培养中靶基因的敲低。(a) 在带有单独星形胶质细胞饲养层的培养皿盖子上的纯神经元培养。直接向培养基中加入LNP-siRNA。(b) DiI荧光(红色)显示LNPs存在于神经元的细胞质中。底部:荧光图像堆叠的横截面分析和透射红外图像显示,DiI点在细胞膜的边界内。比例:15 μm。(c) LDH释放量化显示,在所用浓度下LNPs无毒性。(d) 与luc siRNA-LNP对照和未处理的培养物相比,Western印迹显示LNP-PTEN siRNA导致PTEN蛋白质的敲低。(e) LNP-siRNA浓度对PTEN敲低的剂量反应,Z后一列显示未包封的siRNA未导致蛋白质的敲低。在所有图中,实验值均为均值和SEM。LDH,乳酸脱氢酶;LNP,脂质纳米颗粒;NS,不显著;siRNA,小干扰RNA。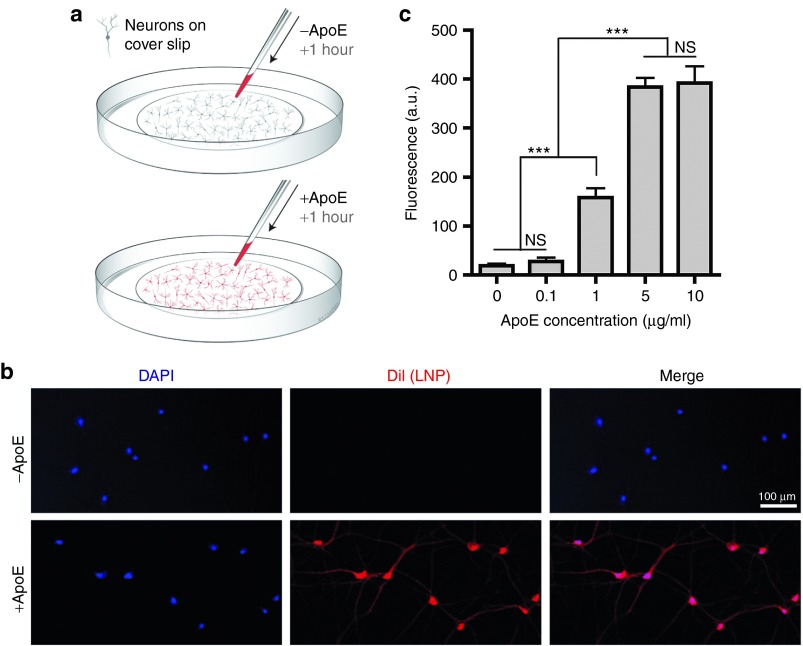
图3,脂质纳米颗粒(LNPs)以载脂蛋白E(ApoE)依赖性方式被神经元摄取。(a,b)在星形胶质细胞缺失的情况下,添加ApoE促进神经元摄取LNPs,表现为DiI荧光的增加。处理:1小时LNP-siRNA ± ApoE。比例:100 μm。(c)LNP摄取量与ApoE浓度的剂量依赖性,以DiI荧光测定。在所有图中,实验值均为均值和SEM。***P < 0.001。DAPI,4',6-二<unk>基-2-苯基吲哚;NS,不显著;siRNA,小干扰RNA。
图4,LNP-siRNA系统介导体内靶基因的敲低。(a)使用玻璃微量移液器将LNP-siRNA直接注入体感皮质。(b)单次注射LNP-siRNA后5天急性脑片成像显示活的神经元(AM染料)已摄取荧光LNPs(DiI)(c,d)Western blots显示注射LNP-PTEN siRNA与未注射半球和luc siRNA-LNP注射大鼠的组织相比,导致PTEN蛋白的敲低。5天后从注射部位1mm内解剖组织。(e)分析用钙黄素-AM染色活细胞的密度显示,体内摄取LNP(200-500 μm)没有毒性或细胞损失的迹象。(f)从luc siRNA-LNPs处理的急性脑片中测定的TNF-α ELISA显示脑组织对LNP缺乏免疫刺激反应。阳性对照,LPS处理的片显示TNF-α增加。(g)从LNP阳性组织(注射处100-500 μm)测定的TNF-α ELISA与LNP阴性的未注射半球无显著差异。测量结果标准化为0.5 mg蛋白质。*P < 0.05;***P < 0.001。ELISA,酶联免疫吸附测定;LNP,脂质纳米颗粒;LPS,脂多糖;NS,不显著;siRNA,小干扰RNA;TNF-α,肿瘤坏死因子-α。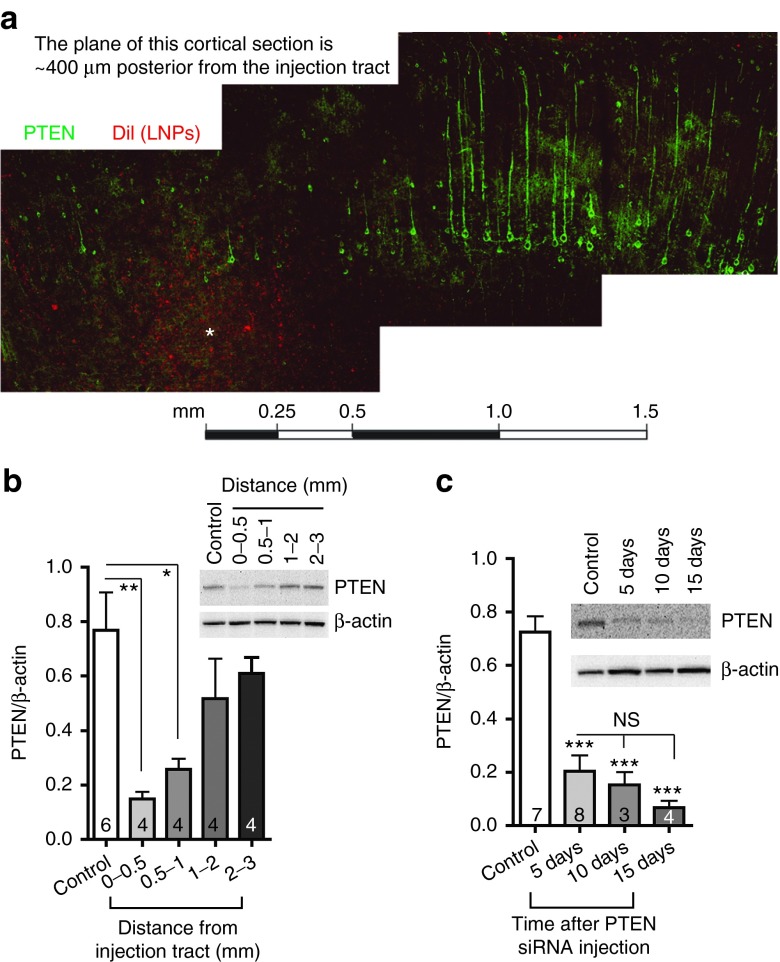
图5,体内蛋白质敲低的距离分布和时间进程。(a) 在距离LNP-siRNA注射部位不到1mm的神经元中,PTEN蛋白的免疫荧光降低。图示蒙太奇是从注射通道后方的剖面获得的,星号表示距离注射400μm的点。(b) 一个示例的Western blot(插入)显示在距离注射通道不到1mm的组织中PTEN蛋白降低。柱状图显示了在邻近LNP-siRNA注射部位不同距离解剖的组织上的Western blot的汇总数据。(c) Western blot显示在单次颅内注射LNP-siRNA后5、10和15天时PTEN的持续敲低。*P < 0.05;**P < 0.01;***P < 0.001。LNP,脂质纳米颗粒;NS,不显著;siRNA,小干扰RNA。
图6,脂质纳米颗粒(LNPs)经侧脑室注射后能够广泛分布和敲低。(a)海马CA1区DiI荧光显示细胞体层(sp)神经元对LNPs的摄取。 尺度:25 μm。(b-d)Western印迹显示经侧脑室注射siRNA-LNPs导致不同脑区(背侧海马和纹状体)靶蛋白(PTEN)的敲低。*P < 0.05;**P < 0.01。siRNA,小干扰RNA; so,东方层; sp,锥体层(细胞体层); sr,辐射层。
参考文献:
Rungta RL, Choi HB, Lin PJ, et al. 2013 Dec 3;2(12):e136.
相关产品
全部评论(0条)
推荐阅读
-
- siRNA体内递送的高强度极限大小脂质纳米颗粒的微流合成
- 脂质纳米颗粒是治疗癌症应用的小干扰RNA(siRNA)载体,这里显示了允许在纳升级进行毫秒混合的微流体混合技术,可重复生成极限大小为20 nm或更大LNP siRNA系统,并在多态性指数低至0.02的广泛条件下基本上完全包封了siRNA。
-
- siRNA体内递送的高强度极限大小脂质纳米颗粒的微流合成
- 脂质纳米颗粒是治疗癌症应用的小干扰RNA(siRNA)载体,这里显示了允许在纳升级进行毫秒混合的微流体混合技术,可重复生成极限大小为20 nm或更大LNP siRNA系统,并在多态性指数低至0.02的广泛条件下基本上完全包封了siRNA。
-
- 可调刚性PLGA壳-脂质核纳米颗粒在2D和3D肺癌细胞模型中增强肺siRNA递送
- 本文研究的目标是探讨设计非病毒siRNA载体以增强吸入肺肿瘤治疗的可行性。在这里,通过在载有siRNA的阳离子脂质体(Lipoplexes)上涂覆PLGA,通过微流控技术制备了壳核基聚合物-脂质杂化纳米颗粒(HNPs)。
-
- Andrew+移液机器人新技能 | 高通量制备用于递送mRNA的脂质纳米颗粒(LNP)
- Andrew+移液机器人新技能 | 高通量制备用于递送mRNA的脂质纳米颗粒(LNP)
-
- 流动聚焦结构混合器:LNP脂质纳米颗粒、PLGA纳米颗粒
- 流动聚焦结构混合器:LNP脂质纳米颗粒、PLGA纳米颗粒
-
- RNA递送用脂质纳米颗粒配方与制备的全面分析(2024年12月,微小RNA空间转录,核酸疗法,mRNA-LNP纳米药物递送)
- 核酸疗法是一种广泛应用于多种疾病的常见治疗方法。脂质纳米粒(LNPs)是有RNA稳定性、强转染效率、可调节药代动力学、有限毒性和已证实可转化的有前途的递送载体。本文介绍了基于脂质的递送系统,阐述了应用的必要性,同时对每个组成进行了全面分析。
-
- 探究mRNA脂质纳米颗粒产品中的不溶性微粒
- 跟随MicroRaman来探索LNPs产品的微观世界吧!
-
- 探究mRNA脂质纳米颗粒产品中的不溶性微粒
- 跟随MicroRaman来探索LNPs产品的微观世界吧!
-
- 探究mRNA脂质纳米颗粒产品中的不溶性微粒
- 跟随MicroRaman来探索LNPs产品的微观世界吧!
-
- 探究mRNA脂质纳米颗粒产品中的不溶性微粒
- 跟随MicroRaman来探索LNPs产品的微观世界吧!
-
- 以 SOTAX TPW 从脂质纳米颗粒中自动提取mRNA
- 分离mRNA的手动提取过程劳动强度大、耗时长,容易受到RNAse污染。默克公司的研究人员成功把从LNP中提取mRNA的程序自动化,克服了这一技術瓶頸。
-
- 布鲁克创新技术攻克脂质纳米颗粒(LNP)降解产物分析难题
- ASMS Poster# 布鲁克创新技术脂质纳米颗粒(LNP)降解产物分析1前言脂质纳米颗粒(Lipid n
-

- 猪肝原代细胞培养中siRNA调控THRSP基因表达研究
- 特异性siRNA靶向抑制猪肝原代细胞中甲状腺激素应答蛋白(THRSP)基因的表达,结合威尼德电穿孔仪优化转染条件,探讨THRSP在脂代谢中的功能。
-

- 化学合成siRNA精准递送突破肝癌原代细胞转染壁垒
- 构建阳离子聚合物/化学siRNA纳米复合物,结合威尼德电穿孔仪优化递送程序,实现肝癌原代细胞高效转染。纳米颗粒粒径85.3±4.2 nm(PDI 0.18),转染效率达89.7%±2.4(vs脂质体法
-

- 化学合成siRNA高效转染突破成骨细胞递送技术瓶颈
- 开发聚乙亚胺/化学siRNA纳米递送系统,联合威尼德电穿孔仪优化转染参数,突破成骨细胞递送屏障。
-

- 电穿孔优化突破原代软骨细胞siRNA递送技术瓶颈
- 通过系统优化威尼德电穿孔仪参数,建立原代软骨细胞siRNA递送新策略。采用梯度脉冲电压(200-400 V)联合间歇式电场刺激,转染效率提升至82.3%±3.1(vs传统方法38.5%±5.2)
-
- 细胞与基因疗法新突破:脂质纳米颗粒助力高效无害的体外基因编辑
- 更多相关内容,欢迎文末扫码下载Cytiva LNP解决方案
①本文由仪器网入驻的作者或注册的会员撰写并发布,观点仅代表作者本人,不代表仪器网立场。若内容侵犯到您的合法权益,请及时告诉,我们立即通知作者,并马上删除。
②凡本网注明"来源:仪器网"的所有作品,版权均属于仪器网,转载时须经本网同意,并请注明仪器网(www.yiqi.com)。
③本网转载并注明来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
④若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi
最新话题
最新文章
- “纲举目张,疏而不漏”—mNGS/tNGS助力急性呼吸道传染病监测
- 打破传统,可穿戴心电监测技术最新突破
- 【从有创到无创】我们如何让0.1mm的传感器读懂小动物血压信号?
- 南京大展的热重分析技术助力华南理工塑料研究突破荣登SPE期刊
- 2025版《中国药典》解读!飞纳电镜在医药行业和药包材行业的应用
- 近红外显微镜在VCSEL氧化孔径测量中的技术与应用以卡斯图MIR100为例
- 四大工业常用策略,助力降低抗体高甘露糖修饰
- 近红外显微镜赋能2.5D封装检测苏州卡斯图电子MIR800
- 近红外显微镜在倒装芯片检测中的应用及技术解析以卡斯图MIR200为例
- 西恩士工业|为什么新能源汽车对汽车零部件清洁度要求那么高?
作者榜
-

-

- 艾仪尔(石家庄)科技有限公司
- 粉丝:1关注:1
-

- 北京鑫视科科技有限公司
- 粉丝:1关注:1
-

-

-

-

-

- 上海喆图科学仪器有限公司
- 粉丝:1关注:1
-

-




















参与评论
登录后参与评论