Tumor-infiltrating lymphocytes (TILs) 是指浸润肿瘤组织的淋巴细胞。淋巴细胞是免疫系统中的重要组成部分,负责识别和攻击异常细胞,包括癌细胞。
流式细胞术对TILs的分选提供了一个重要的工具,用于表征、纯化和研究浸润肿瘤的免疫细胞群。它有助于研究人员了解TILs的组成、功能和潜在的治 疗相关性,推动我们对肿瘤与免疫相互作用的理解。
我们使用流式细胞术来分选TILs主要应用场景如下:
01、鉴定和表征:
流式细胞术允许我们根据TILs表面标记物的特征来鉴定和表征不同的亚群。通过使用针对CD3、CD4、CD8和其他免疫细胞标记物的特异性抗体来标记细胞,我们可以区分和定量TILs中的各种T细胞亚群。这有助于我们了解肿瘤微环境中TILs的组成和多样性。
02、特定TIL亚群的纯化:
流式细胞术分选使我们能够分离和纯化感兴趣的特定TIL亚群。通过基于表面标记物的表达,对细胞进行分选和筛选,我们可以收集纯净的TIL亚群用于进一步的下游应用。这使研究人员能够研究特定的TIL亚群,并研究其功能特性或基因表达谱。
03、功能分析:
分选后的TILs可用于功能性分析,以评估其免疫活性和功能。例如,可以测试分选后的TILs的增殖能力、细胞因子产生、对肿瘤细胞的细胞毒性或其他功能性实验。这些分析提供了有关TIL亚群功能能力和潜在抗肿瘤免疫反应的见解。
04、基因组学或蛋白质组学分析:
流式细胞术分选可以获得纯净的TIL细胞群,进而进行基因组学或蛋白质组学分析。通过分析分选TILs的基因表达或蛋白质谱,研究人员可以更深入地了解与TILs在肿瘤免疫中相关的分子机制和信号通路。
然而不同于外周血、脾 脏中的淋巴细胞,TILs的流式检测存在更多的不确定性,需要有效优化包括样本处理、配色方案、上样条件以及分析方法等实验设计的各个方面,才能实现更为准确、真实的多色复杂样本流式检测。
图1为外周血来源样本淋巴细胞分型的流式检测数据,由图可见,淋巴细胞群体T、B细胞分群明显,T细胞亚群也可清晰区分。另外,我们也可以看到,该数据以FSC通道设定阈值,其阈值设定值较低,导致碎片及噪音信号干扰明显,不过由于血液样本碎片较少,与细胞分群明显,故而对最 终结果的影响并不大。
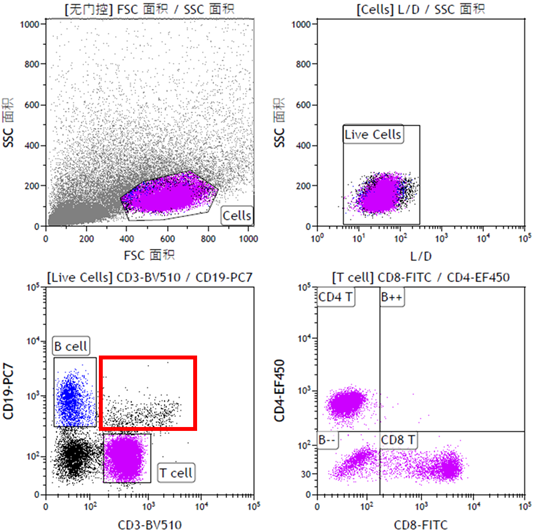
图1 血液样本淋巴细胞免疫分型流式数据
然而,当我们使用同样的模板检测肿瘤组织样本时,数据就出现了明显问题。实体瘤组织细胞构成复杂,并且在将组织样本制备成单细胞样本的过程中会产生大量的细胞碎片,这些杂质细胞及碎片会对流式检测造成显著的干扰。如图2所示,T细胞中出现了大量CD19和CD3双阳性细胞,不符合已有文献报道的结果。这些双阳性细胞主要是由于杂质细胞及碎片的非特异干扰导致的。这些干扰对于流式检测及流式分选的准确性有很大影响,甚至会导致得出错误的结论。
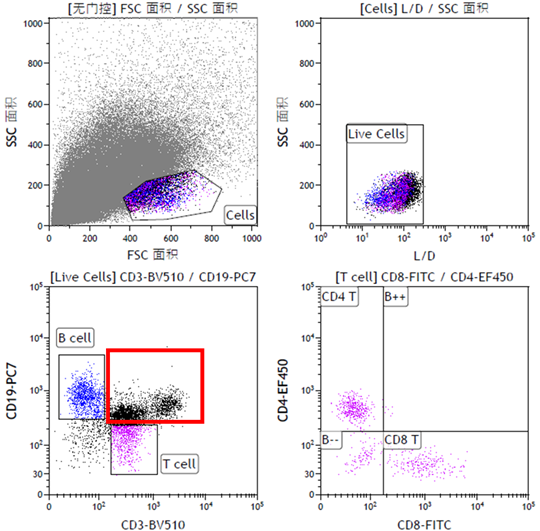
图2 浸润肿瘤组织的淋巴细胞免疫分型流式数据
那么,基于以上数据,我们应该如何优化实验设计以提高浸润肿瘤组织的淋巴细胞分选的准确性呢?这里给大家以下几点建议:
01、增加Pan-Marker检测:
这里的Pan-Marker是指目标细胞群均表达,但其他细胞群体及碎片不表达的表面标记。CD45广泛表达于免疫系统的各个细胞亚群上,但在非免疫细胞上没有表达或表达很低。因此,在检测淋巴细胞等免疫细胞时,可通过检测CD45是否表达来区分免疫细胞及非免疫细胞,以达到排除杂质细胞干扰的目的。
02、优化样本制备方案:
对复杂样本来讲,样本制备方案是否合适决定了流式实验的成功率。可根据文献报道并通过预实验来选择最 佳的消化酶配方和消化时间,在确保细胞得率的同时尽量减少杂质干扰并最 大限度的保存细胞活性及功能。此外,选择合适的细胞分离手段进行目的细胞的富集。例如,若针对淋巴细胞检测,利用Ficoll或Percoll密度梯度离心法富集单个核细胞,可有效去除脂肪、碎片及杂质细胞的干扰。
03、进行Fc封闭:
组织浸润的多种细胞,特别是单核/巨噬细胞以及DC细胞高表达抗体Fc端的受体。这些细胞在进行流式抗体标记时,即使不表达相关抗原,也可通过Fc受体非特异性的结合流式抗体的Fc端,从而导致非特异信号。要解决这一问题,可购买商业化Fc封闭试剂,在标记流式抗体前进行Fc封闭即可。
04、合理设定阈值:
阈值的设定与实验目的息息相关。在流式分析实验中,应当设定阈值去除绝大部分噪音及碎片信号,仅保留少量碎片信号即可。在流式分选实验中,若分选所得细胞用于培养,同样应当设定阈值去除绝大部分噪音及碎片信号,仅保留少量碎片信号,这样做可以有效提高分选效率及回收率;但若分选所得细胞用于qPCR、测序,特别是单细胞测序等基因组学应用,由于碎片中含有一定量的核酸片段乃至细胞核碎片,在分选过程中就需要将尽可能多的碎片与目的细胞区分,因此应当设定较低的阈值以暴露足量的碎片信号让分选仪器检测到,进而有效确保分选所得目的细胞不掺杂核酸碎片,以免影响后续实验准确性。
05、利用空白荧光通道排除非特异:
什么是空白荧光通道呢?举一个例子,我们设计一个3色实验标记FITC、PE、PE-Cy7三种染料,没有标记APC,在检测时APC通道就是空白通道,是不应该有阳性信号的。复杂样本中的部分杂质细胞有较强的非特异荧光信号,通常这些非特异的荧光信号在所有的流式荧光通道中均可检测到。基于这一原理,我们可在上样时预留一到两个空白荧光通道,样本中的目的细胞没有标记这些空通道的荧光素,在这些通道里面是阴性的,而杂质细胞的非特异信号在空白通道中通常也是阳性的,我们就可以通过设门选择空白通道中的阴性细胞来达到去除非特异信号的目的。需要注意的是,利用这一方法时要充分考虑补偿的影响,最 好选择与已用通道补偿小或无补偿的通道作为空白通道。
06、增加细胞死活染料:
死细胞的非特异性地结合会增加假阳性。死细胞会产生自发荧光干扰特定信号的检测。在TILs分选中去除死细胞。可以增加数据准确性:死亡的细胞可能会释放细胞碎片和细胞内成分,这可能会干扰实验结果,引入假阳性或假阴性结果。通过去除死细胞,可以提高分选结果的准确性和可靠性。并且为分选后TILs细胞活力提供保证:分选到活细胞可以保证后续实验的有效性和可靠性。死亡细胞不具备正常的生物活性和功能,因此分选到活细胞可以确保后续实验能够反映真实的细胞生物学状态。
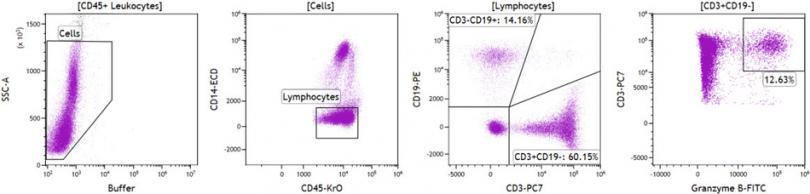
图3 无死细胞排除处理的样本分析比较
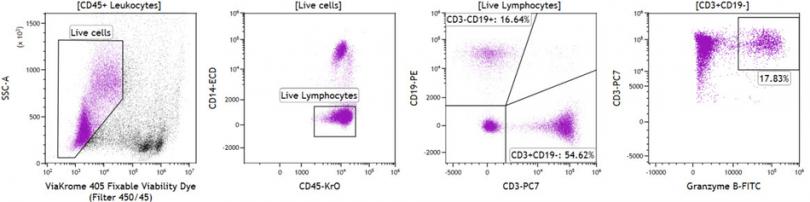
图4 有死细胞排除处理的样本分析比较
复苏后的PBMC在免疫染色之前不添加(图 3)或者添加ViaKrome 405可固定活性染料(55℃,10分钟)(图 4)。然后,使用Perfix-nc细胞染色试剂盒(型号 B10825)处理细胞,并用Granzyme B-FITC、CD19-PE、CD14-ECD、CD79a-PC5.5、CD3-PC7 和 CD45- Krome Orange 进行染色。
数据统计信息显示:两个不同条件下,门内细胞在上一门级百分比也不一样,充分展示了消除死细胞以后的数据效果。
 流式高手来PK | 流式分选小技巧有奖征集
流式高手来PK | 流式分选小技巧有奖征集

 评论
评论