利用深层视觉蛋白质组学,结合激光显微切割、人工智能(AI)和质谱分析进行单细胞鉴别和细胞异质性研究。
尽管可使用基于成像和质谱的方法进行空间蛋白质组学研究,但是图像与单细胞分辨率蛋白丰度测量值的关联仍然是个巨大的挑战。最近引入的一种方法,深层视觉蛋白质组学(DVP),将细胞表型的人工智能图像分析与自动化的单细胞或单核激光显微切割及超高灵敏度的质谱分析结合在了一起。DVP在保留空间背景的同时,将蛋白丰度与复杂的细胞或亚细胞表型关联在一起。
阅读完整文章:
A. Mund, F. Coscia, A. Kriston, R. Hollandi, F. Kovács, A.-D. Brunner, E. Migh, L. Schweizer, A. Santos, M. Bzorek, S. Naimy, L.M.Rahbek-Gjerdrum, B. Dyring-Andersen, J. Bulkescher, C. Lukas, M.A. Eckert, E. Lengyel, C. Gnann, E. Lundberg, P. Horvath, M. Mann:深层视觉蛋白质组学定义单细胞的同一性和异质性《Nature Biotechnology》(2022年)第40卷,1231–1240页DOI:10.1038/s41587-022-01302-5
关于本文章
单独切除细胞培养物中的细胞核,使用已知且未表征蛋白定义的蛋白质组学谱对不同的细胞状态进行分类。在存档的原发性黑色素瘤组织中,DVP [1] 将空间分辨的蛋白质组变化鉴别为正常的黑色素细胞转化为完全侵袭性黑色素瘤,这揭示了随着肿瘤进展而以空间方式变化的路径,如转移性垂直生长中的mRNA剪接调节异常与干扰素信号和抗原呈递降低同时进行。DVP在组织背景中保留精密空间蛋白质组学信息的能力对临床样本分子表达谱具有一定的意义。
在本研究中,细胞或细胞核使用LMD7激光显微切割显微镜进行切割,该显微镜经过调整,适用于自动化的单细胞自动切割[1]。
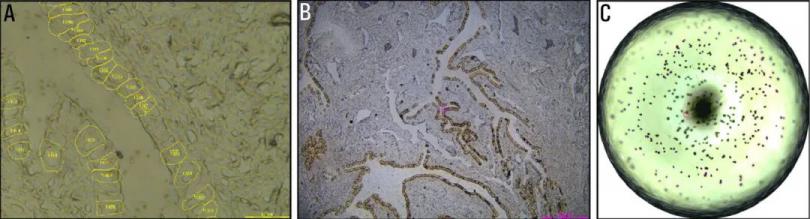
图1:A) 输卵管上皮细胞激光显微切割前在LMD7软件中的轮廓对齐B) 激光显微切割后的截图。C) 单个输卵管上皮细胞激光显微切割后的384孔检查。
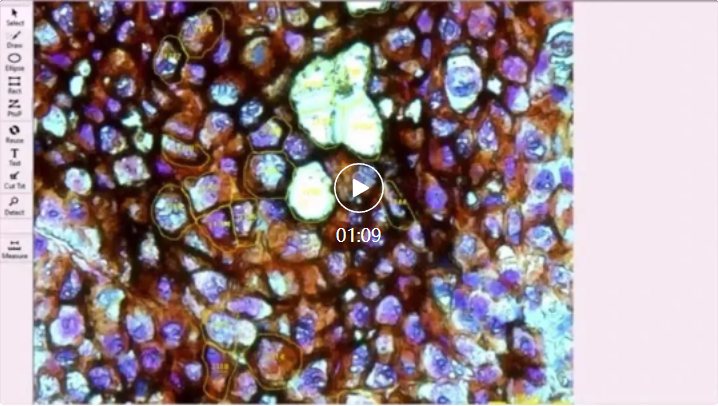
视频1:自动化LDM单细胞分离
References:
1.Automated Laser Microdissection for Proteome Analysis (Deep Visual Proteomics), Flyer, Leica Microsystems, 2022.
2.Rosenberger FA, Thielert M, Strauss MT, Ammar C, Mädler SC, Schweizer L, Metousis A, Skowronek P, Wahle M, Gote-Schniering J, Semenova A, Schiller HB, Rodriguez E, Nordmann TM, Mund A, Mann M: Spatial single-cell mass spectrometry defines zonation of the hepatocyte proteome, bioRxiv, 3. Dec 2022, doi: https://doi.org/10.1101/2022.12.03.518957

 评论
评论