原创 飞飞 赛默飞色谱与质谱中国
关注我们,更多干货和惊喜好礼

张晓夕

在整个制药行业中,重组单克隆抗体 (mAb) 为生物治疗产品在销售额和临床份额的快速增长起到了重要作用。最近,因为独特的治疗效果,复杂的蛋白质包括抗体-药物偶联物 (ADC)、双特异性抗体和融合蛋白等重新获得了科学家们的特别关注。在蛋白质药物的关键质量属性(critical quality attribute, CQA)评估过程中,电荷异质性需要对蛋白分子进行深入的结构表征,以确保其安全性、有效性和效力。
此外,对电荷变异体的监测也是蛋白质药物质量控制(QC)中必要的步骤。目前,主要有两种检测蛋白质药物电荷变异体的方法:离子交换(IEX) 色谱和成像毛细管等电聚焦(iCIEF) 或 CIEF,两者传统上都使用 紫外(UV) 作为检测器。UV检测虽然具有良好的稳定性和灵敏度,但受限于其定性能力,无法对分离后的电荷变异体进行更深入的鉴定。为了分析电荷异构体的成因,必须进行准确的定性分析。高分辨率质谱(HRMS)是定性蛋白质分析的有力手段之一。然而,由于所用溶液体系的限制,传统上IEX 和 iCIEF 不能直接与质谱连接。鉴于iCIEF在蛋白质电荷变异体分析中具有分辨率高、通量高等优点,已经逐渐成为生物制药行业生产与质量控制阶段的金标准。因此,科学家们也在尝试各种将iCIEF与高分辨质谱直接连接的技术。其中一种方法是基于芯片的直连技术,然而该方法是使用化学试剂形成pH梯度,稳定性有所欠缺,且分辨率会下降;其他的直连方法在通量、稳定性以及与质谱离子源连接的便利性等方面均有不足。
本文中所使用的CEInfinite (Advanced Electrophoresis Solution Ltd., AES) iCIEF平台,与该公司的专利卡柱和两性电解质配合使用,对mAb、ADC等分子的电荷变异体均可实现高分辨率分离,且兼具良好的稳定性。更为重要的是,所用溶液体系中无甲基纤维素、尿素等,两性电解质也与质谱兼容,这使得iCIEF与高分辨质谱在线直连测量电荷变异体完整蛋白分子量成为可能。该平台与质谱离子源部分连接简单,无需额外接口(图1),不同工作模式切换简便。
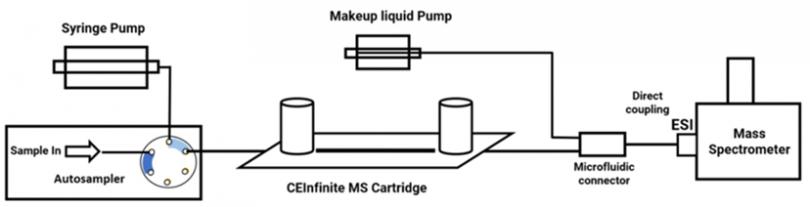
图1. CEInfinite iCIEF平台质谱直连模式工作原理图
(点击查看大图)

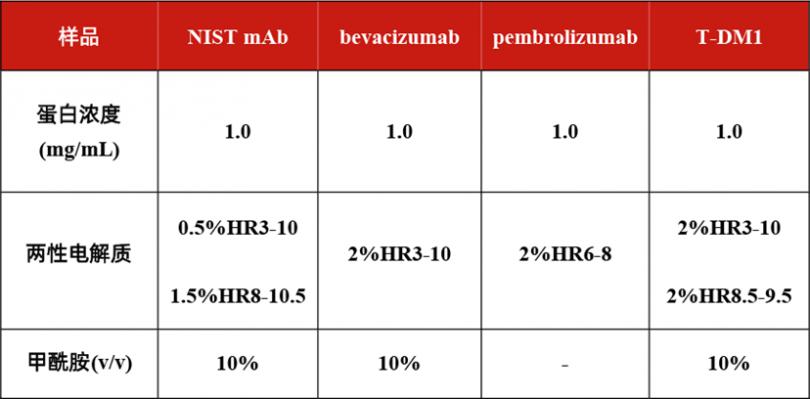
在本文中,我们对NIST mAb(NIST8671)、bevacizumab和pembrolizumab,以及T-DM1这一赖氨酸偶联的ADC药物进行了iCIEF-HRMS在线直连分析。根据每个分子及其电荷变异体的pI分布,我们选择了不同范围的两性电解质(表1),目的在于实现不同电荷变异体之间更好的分离。
表1. 样品配制
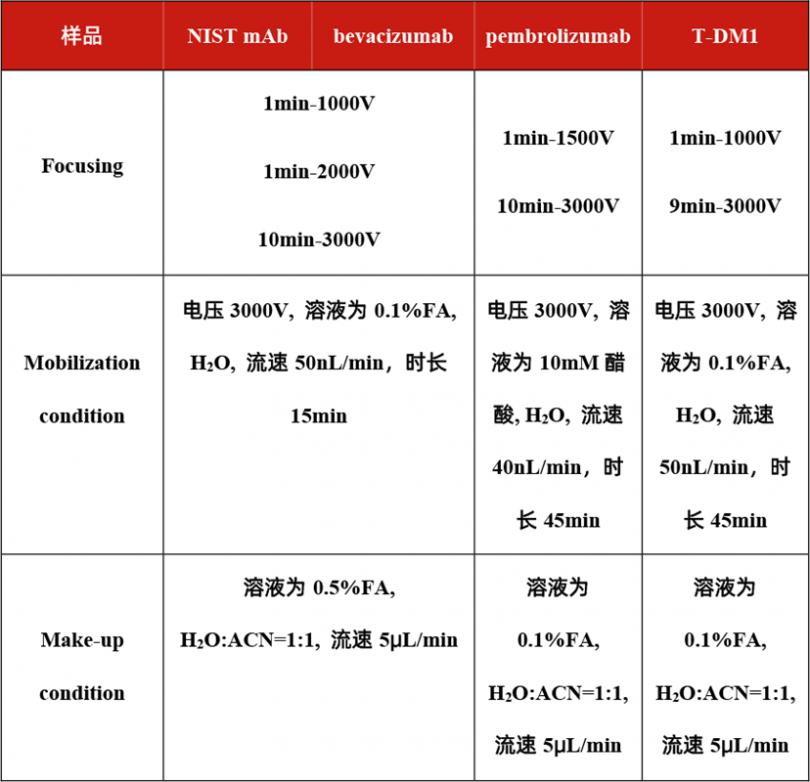
对于每个分子,我们也根据其不同性质优化了iCIEF实验条件,详见表2。
表2. iCIEF分离条件

实验条件的优化
由于每个蛋白及其电荷变异体的等电点(pI)分布范围存在差异,为了在直连质谱时得到好的分离效果,需要进一步优化iCIEF分离条件。优化时,先用pH范围较宽的两性电解质分析目标蛋白得到初步结果,然后再根据初步结果中每个组分不同的pI分布范围,选用相应的窄pH范围两性电解质(优化过程数据未展示)。
在iCIEF的聚焦过程中,蛋白会在电场形成的pH梯度中迁移,直至到达pH=pI的位置,迁移停止。由于蛋白在pI处停止后易沉淀,通常会加入一定浓度的尿素助溶。然而尿素与质谱不兼容,为了解决这个问题,我们的实验中换用甲酰胺代替尿素,在助溶的同时,也与质谱兼容;对于每个样品,甲酰胺的浓度同样也进行了优化(数据未展示),对于大部分样品,10%(v/v)甲酰胺是最适合的条件。
在iCIEF-MS直连模式中,需要两路辅助溶剂。一路被称为mobilization solution(蛋白从卡柱上被推出的溶液,由iCIEF系统配备的蠕动泵完成),该溶液通常为10mM醋酸溶液或0.1-0.5%甲酸水溶液;另一路为make-up solution(由HPLC的泵模块提供,在柱后与mobilization混合) ,通常使用0.1%甲酸,水:乙腈=1:1的溶液。
因为这两路溶液的流速会对实验结果造成影响,我们同样对这两个流速分别进行了优化,mobilization solution流速优化范围30-100nL/min, make-up solution流速优化范围1-10μL/min,发现mobilization solution流速在40-50nL/min之间iCIEF分辨率比较好,50-100nL/min分辨率会下降;mobilizaiton solution= 5μL/min,质谱灵敏度更加好。
iCIEF-MS直连模式的重复性
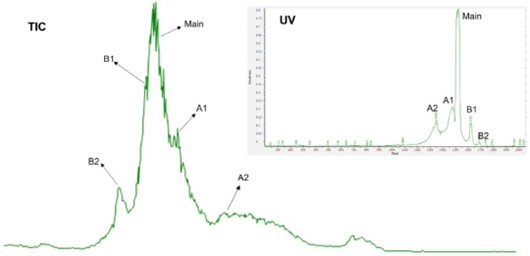
在本实验中,NIST mAb被用于系统稳定性测试。如图2所示,图2A为NISTmAb三针平行进样结果,可见质谱总离子流图(total ion current, TIC chromatogram)和主峰解卷积结果均具有良好的重现性;图2B对NIST mAb的TIC和iCIEF-UV谱图进行了对比,可见iCIEF分离出的五个电荷异质体峰均可与TIC中的峰一一对应。需要注意的是,由于系统直连的模式,iCIEF分离后的峰是按照pI由大到小的顺序依次被引入质谱离子源的,故TIC图上最先被检测到的是pI值最大的碱峰,TIC与iCIEF-UV谱图中峰的分布呈镜像关系。
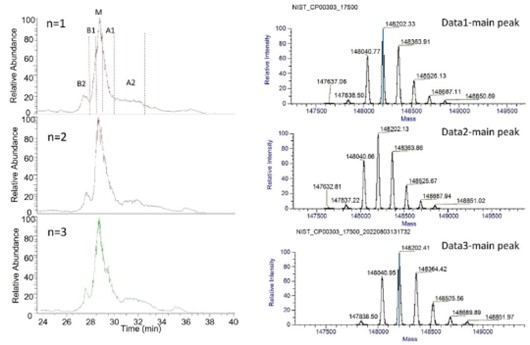
(A)
(B)
图2.iCIEF-MS系统稳定性测试。
(A),NIST mAb三针平行进样。
(B),NIST mAb 质谱总离子流图(TIC)与iCIEF-UV谱图对比。
(点击查看大图)
iCIEF-MS分析bevacizumab
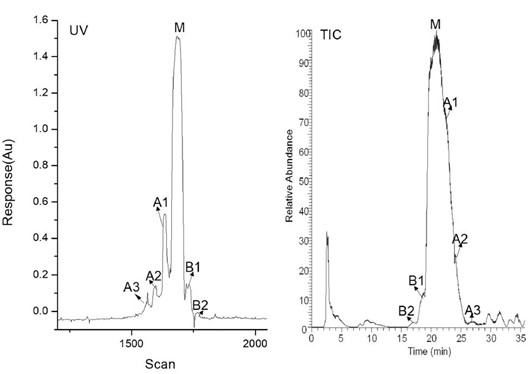
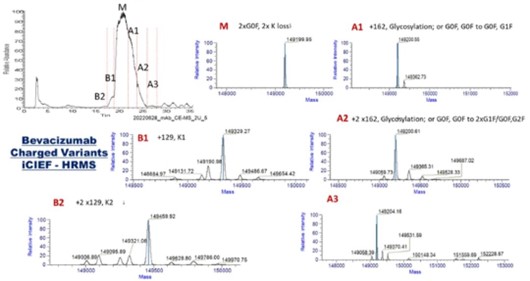
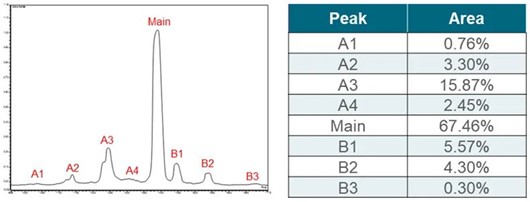
图3展示了iCIEF-MS分析bevacizumab的结果。从图3A的iCIEF-UV谱图中可以看出,总共有六个电荷变异体的峰被分离并鉴定到,包括三个酸峰(A1-A3),两个碱峰(B1-B2)和主峰(M),均可在TIC-MS谱图中找到对应的峰。图3B为使用Thermo Fisher Biopharma Finder 5.0 (BPF 5.0)软件对各个电荷变异体进行解卷积之后的结果,可见在两个碱峰中,主要的电荷变异体分别为重链末端保留一个赖氨酸(B1)和两个赖氨酸均被保留(B2)的形式;在酸峰中,主要观察到的电荷变异体为糖化(+162Da)。
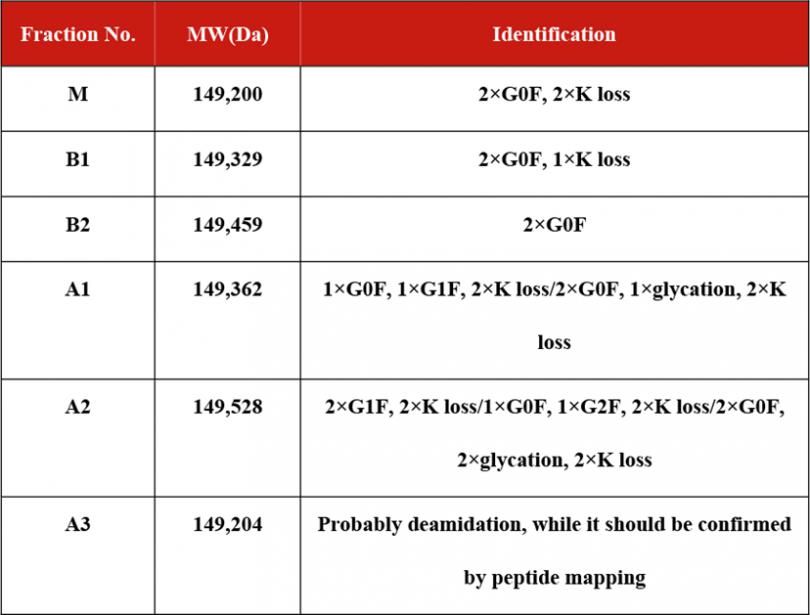
表3列出了iCIEF-MS鉴定到的bevacizumab电荷变异体。对于酸峰中常见的脱酰胺化修饰,由于其修饰后分子量仅增加0.984Da,通常需要在肽图层面上进一步确认。
(A)
(B)
图3. iCIEF-MS分析bevacizumab。
(A), TIC-MS与iCIEF-MS谱图对比。
(B), 经iCIEF分离后的bevacizumab电荷变异体质谱数据解卷积结果。
(点击查看大图)
表3. iCIEF-MS鉴定到的bevacizumab电荷变异体
iCIEF-MS分析pembrolizumab
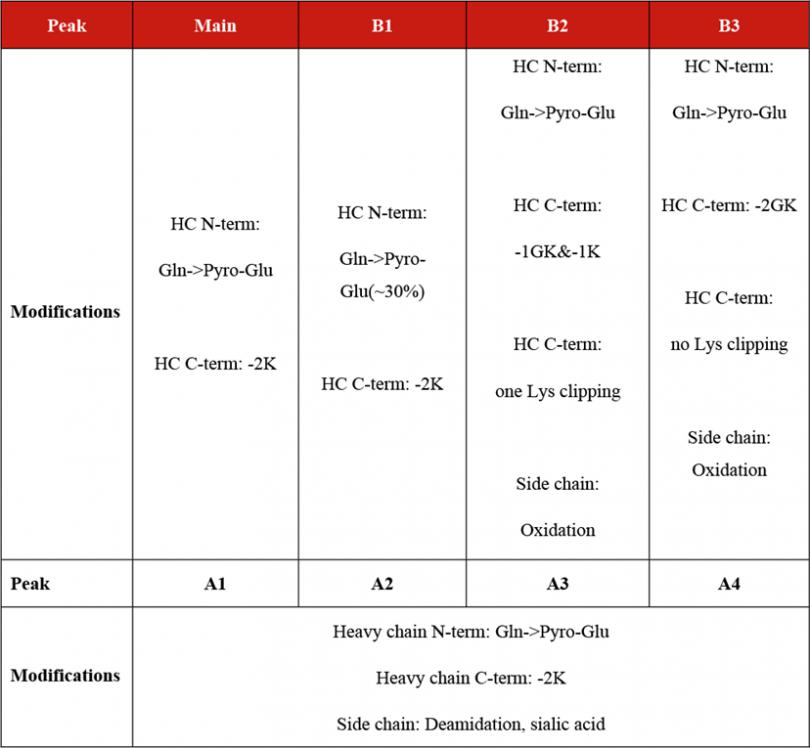
下图4及图5展示了我们使用iCIEF-MS直连技术分析pembrolizumab电荷变异体的结果,可见即使是pI仅差0.02的碱峰B1和主峰,也可以在iCIEF上得到基线分离(图4A),随后的高分辨质谱分子量测定结果显示该碱峰与主峰相比,主要差异是其中一条重链的N端未发生焦谷氨酸环化(图5B-C)。另外观察原始质谱谱图不难发现,得益于Orbitrap高分辨质谱的灵敏度,即使是强度比主峰低2~3个数量级的碱峰B3,仍可得到糖型分布清晰的谱图,并可通过解卷积观察到该峰中各个组分的分子量,例如重链末端丢失GK(-185Da)的电荷变异体也在碱峰B3中被鉴定到(图5D)。表4展示了iCIEF-MS直连测得的每个峰中主要的电荷变异体种类。
(A) (B)
图4. (A), pembrolizumab iCIEF- UV 分离谱图。(B), pembrolizumab各个电荷变异体百分含量,上样量为柱上1.6μg。A1-A4, 酸峰; Main, 主峰; B1-B3, 碱峰。
(点击查看大图)
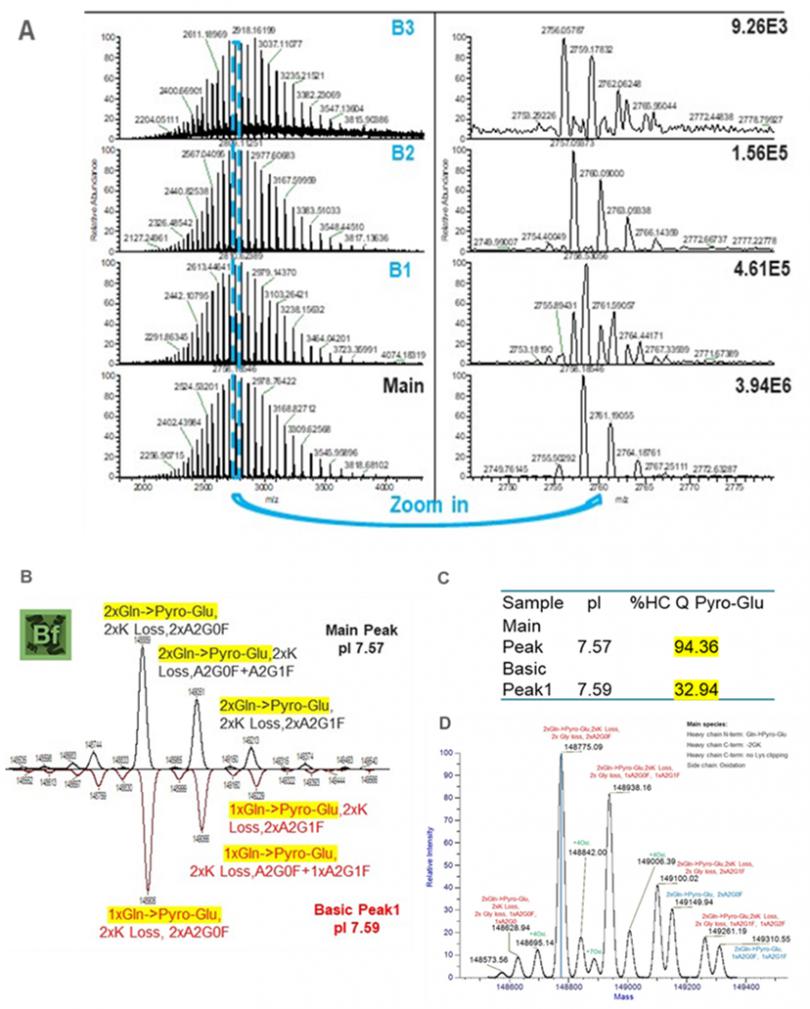
图5. iCIEF-MS分析pembrolizumab电荷变异体质谱图及解卷积谱图。
(A),主峰与所有碱峰原始质谱图对比。
(B),碱峰B1(pI=7.59)与主峰(pI=7.57)解卷积结果镜像图对比。
(C),基于肽图得到的主峰和碱峰B1重链N端焦谷氨酸环化比率。
(D),碱峰B3解卷积结果。
(点击查看大图)
表4 iCIEF-MS在线直联鉴定pembrolizumab电荷变异体。HC,重链。
iCIEF-MS分析ADC
ADC是一类经过细胞工程设计,将小分子药物通过linker分子偶联至mAb分子特定氨基酸位点上,通过mAb对细胞表面的靶点精确识别后,将小分子药物定向导入癌细胞中,以实现精准杀灭癌细胞,减少对正常细胞杀伤的一类蛋白质药物。由于小分子药物的偶联增加了产品的复杂性,故在质谱分析之前,通过各种分离技术对偶联了不同数目小分子药物的ADC进行预分离,可大大降低质谱数据的复杂度和解析难度。图6展示了iCIEF-UV分析ADC的谱图,可见由于偶联小分子药物的数目不同,ADC的电荷异质性也不同,可以在iCIEF层面上得到分离。图7展示了iCIEF-MS分析ADC的质谱谱图及解卷积结果,可见iCIEF将对偶联了不同数目小分子药物的ADC根据其电荷异质性进行分离后,能够减少质谱谱图中相邻信号之间的干扰,从而降低质谱谱图的复杂度,使质谱谱图的解析更精确和便利。
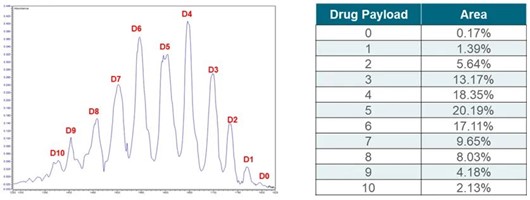
图6. iCIEF-UV 分析T-DM1谱图,上样量1.6μg。D0-D10, 小分子药物偶联数目。
(点击查看大图)
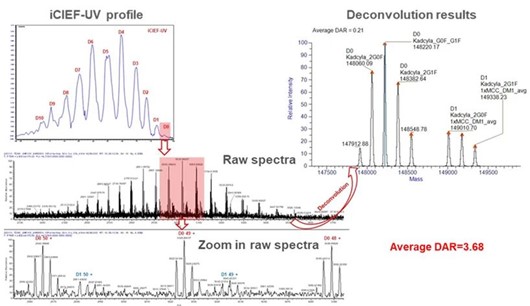
图7. iCIEF-MS分析T-DM1质谱谱图及解卷积结果(分离后未偶联小分子药物的组分,D0)。iCIEF分离大大降低了谱图复杂度。
(点击查看大图)
基于iCIEF分离的
蛋白电荷变异体离线馏分收集
iCIEF-MS可以从完整蛋白层面上提供蛋白电荷变异体的分子量信息,如需更多修饰位点层面的信息,可以对iCIEF分离的蛋白电荷变异体离线馏分收集后进行酶解,随后使用HPLC-MSMS进行肽图表征。图8展示了pembrolizumab蛋白电荷变异体离线馏分收集的iCIEF-UV谱图,更多详细信息可参考已发表文献[1]。
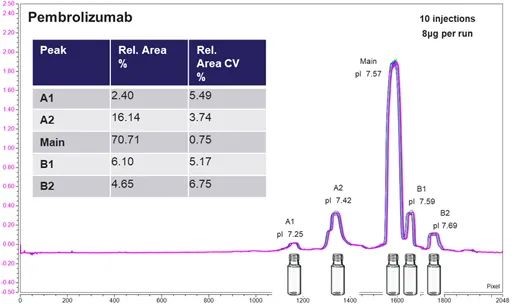
(A)
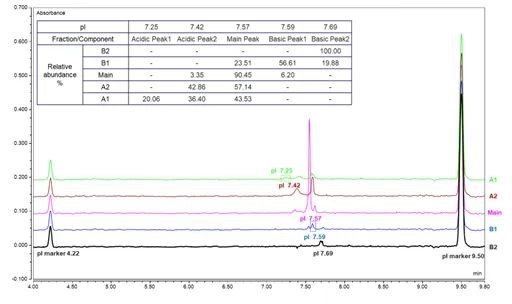
(B)
图8. Pembrolizumab 电荷变异体离线馏分收集及确认。
(A) 离线馏分收集。iCIEF-UV为10针平行进样的重叠,插入表格为每个峰以峰面积计算的相对含量和10针平行进样的CV。
(B) 峰纯度确认,每个峰均为5针平行进样,同一个pI收集峰的混合。
(点击查看大图)

在生物医药行业中,快速且准确的电荷变异体分析是关键需求之一。本文中使用的iCIEF在线直连高分辨质谱工作流程,能够克服CE-MS在灵敏度、重现性等方面的不足,特别是我们使用的CEInfinite平台可以灵活的在不同工作流程之间转换,实现蛋白质电荷变异体表征中的“一站整合式” iCIEF分析。

原文参考
扫码查看
参考文献
[1] X. Zhang, T. Chen, V. Li, T. Bo, M. Du, T. Huang, Cutting-edge mass spectrometry strategy based on imaged capillary isoelectric focusing (iCIEF) technology for characterizing charge heterogeneity of monoclonal antibody, Analytical Biochemistry 660 (2023) 114961.
如需合作转载本文,请文末留言。

 评论
评论