Caspases与细胞凋亡过程相关,因此可以利用caspase检测来确定细胞是否正在经历这种程序化的细胞死亡。这些检测可以通过例如流式细胞仪、平板读数仪实现,也可以在显微镜上完成,显微镜可为量化数据补充可见的结构信息。在这篇文章中,我们描述了MICA是如何用于caspase 3/7测定。借助Navigator或像素分类器等工具,MICA让设置、执行和分析caspase 3/7检测变得更加容易,即使没有经验的用户也可轻松操作。

图像:双色caspase检测并进行拼接扫描。U2OS细胞用核标记物DRAQ5(品红)和CellEvent™(黄色)标记。加入4mM星形孢菌素以诱导细胞凋亡。20倍物镜下使用双通道荧光,持续16小时每30分钟获取一次2x2 FOV(视野范围)的扫描拼接图像。
引 言
凋亡细胞检测或者活细胞/死细胞检测一般通过将某种物质应用于活细胞并观察细胞反应,以此检测其毒性或有效性。死亡率随时间推移而上升或者剂量依赖性上升均证明物质有效。判断潜在药物的抗 癌效果便是一个典型示例。
商用染料试剂盒可检测处于凋亡状态的细胞。这些试剂盒内染料为荧光染料,能够分别标记活细胞和死亡细胞。
Caspase活性检测法是细胞凋亡检测法的一种。Caspase(半胱天冬酶)是参与细胞凋亡过程的一类半胱氨酸蛋白水解酶。它们还用于区分caspase介导的细胞凋亡或细胞坏死。
这里的染料试剂盒使用的是DNA结合试剂,该试剂的荧光能够被四氨基酸肽(DEVD)阻断。一旦caspase-3和caspase-7(caspase-3/7)被激活,即当细胞处于凋亡状态时,caspase-3和caspase-7便会切割DEVD肽,然后DNA结合试剂便会开始呈现荧光。
挑 战
由于添加剂浓度不同、孵育时间不同、染色类型或者细胞系等参数的不同,实验通常在多孔板上进行。这种方法有两个优点,一是能够在一个反应容器中设置多个不同的试验条件,二是只需要极少量的试剂和极低数量的细胞。
但是,在实施过程中,用户仍然可能会被不同孔和不同实验的数量混淆。
设置多孔板实验时,MICA自带的Navigator工具能够帮助预览。包括可以在虚拟画板上计划并设置每一孔的扫描拼接实验或者延时实验(见图1)。
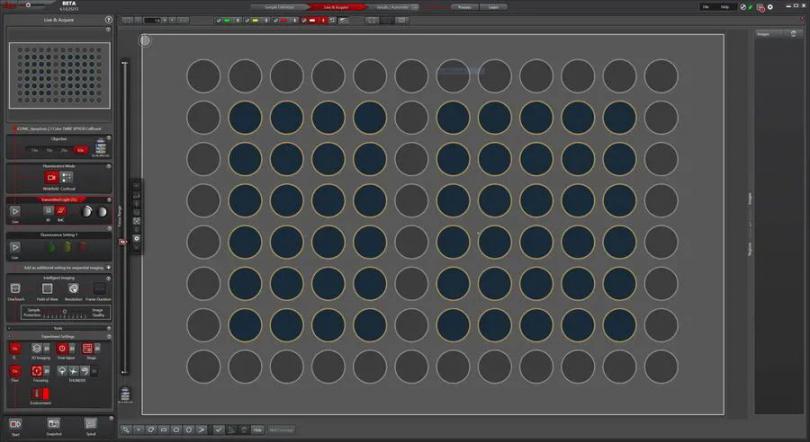
图1:导航工具。Navigator能提供整个样品载体的预览(例如,玻片、培养皿、孔板),并帮助用户设置实验。用户能够在整个孔板上操作导航并进入单孔内,比如界定感兴趣区域或者设计扫描拼接。
追踪细胞活动需要使单一荧光通道的时空相关性成像。传统的宽场显微镜一般一次记录一个通道,因此每一个细胞结构只能按顺序、一个接一个地记录下来。这意味着两个不同的结构记录于两个不同的时间点。这对于极速发生的细胞事件来说可能会产生影响,特别是在共定位研究中。
同时成像通过在同一时间记录全部荧光的方法规避了这一缺点。对于caspase活性检测法而言,这意味着用户能够观察到,例如在caspase-3/7被激活的瞬间线粒体的反应。
MICA能够同时检测四种荧光,使用户可以同时观察到除细胞核、caspase-3/7活性、线粒体等之外的另一个细胞结构(见图5)。
最 后,如果想要确定某一特定试剂在诱导caspase介导细胞凋亡时的效果,则需要对caspase检测进行量化。这种量化需要通过专门的外部软件来实现。
MICA自带分析解决方案,不需要另外的软件。通过MICA自带的像素分类器,用户能够标记一些感兴趣区域(ROI),人工智能算法可以训练和识别这些区域(见图2)。对于caspase活性检测法而言,细胞核信号可用于确定细胞总数。CellEvent™信号可用于识别caspase介导的凋亡细胞。
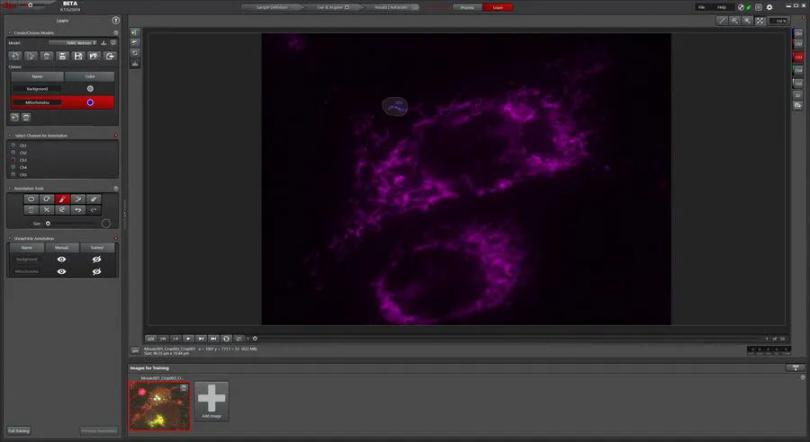
图2:利用像素分类工具训练MICA识别图像中样品特征。通过在图像中标记示例特征,像素分类器能够训练和划分所有目标物。
方 法
在这一案例研究中, U2OS细胞或者COS7细胞被铺在96孔板,然后培养一整晚的时间。在实验过程中,活细胞分别用DRAQ5、SPY-650-DNA以及TMRE孵育15分钟。之后,更换培养基,在实验结束前使用CellEvent™孵育细胞。每孔内加入凋亡诱导剂星形孢菌素(3 µM–7 µM)。
在四色caspase活性检测法中,U2OS细胞被接种在96孔板上并在夜间生长,然后培养一整晚的时间。在实验过程中,活细胞与DAPI和TMRE孵育45分钟。之后,更换培养基,在实验结束前使用CellEvent™和SiR-Tubulin孵育细胞。每孔内加入凋亡诱导剂—星形孢菌素(3 µM–7 µM)。
在37℃、5% CO2和~65%湿度的环境中,按照指示的时间间隔和持续时间用MICA进行活细胞成像。使用Navigator工具设定并执行检测。一些实验中会运行扫描拼接(参见视频2)。进行扫描拼接时,研究人员使用的主要策略是“focus Map”;此外,延时实验通过“Keep focus”来保持细胞的聚焦。
使用MICA自带的分析功能进行本次实验中的数据分析。其中核心组件之一便是人工智能驱动的像素分类器,该功能位于“Learn”选项。
通过像素分类器,用户能够标记其感兴趣区域(ROI),该区域将作为所有要检测的其他区域的示例。如图5所示,细胞核被像素分类器标记并检测。像素分类器同样能够标记并检测线粒体活性标识TMRE和caspase呈阳性的细胞。之后会在整个延时摄影过程中分析这批图像。
经过计算之后,MICA会将计算结果以散点图、共定位图、直方图、饼状图、框图或者时间序列图的形式展示在“结果”选项中。
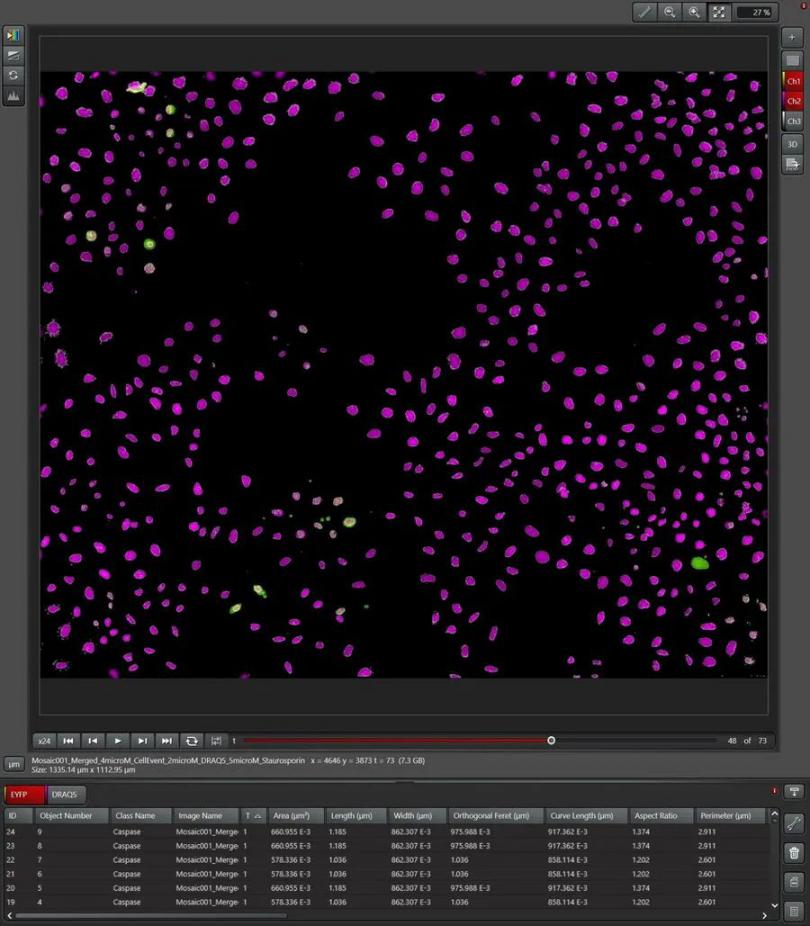
图3:在分析过程中,MICA会标记作为样例的感兴趣区域,为人工智能驱动的分析功能提供信息。在此检测法中,细胞核(品红)和caspase阳性细胞(绿色)会被用于训练像素分类器,通过这种方式,像素处理器便有能力分析caspase介导的凋亡细胞比例。
结 果
SPY-650-DNA(标记细胞核)和CellEvent™(标记caspase 3/7活性)两种细胞染料的量化研究揭示了在活细胞实验中发生caspase介导的凋亡细胞。细胞核的数量说明了每张图像中细胞的数量,可与处于凋亡过程中细胞的数量相对应。另一个标记,即TMRE成像过程,揭示了线粒体活性。
量化数据(如长度、宽度、面积)显示在采集图像下方的表格中,这些数据可被导出为Excel表格。获取的图像可以在延时成像的每一个时间点上查看,并可以与识别的ROI重叠。
三色caspase 3/7活性检测图(图4)显示,细胞核信号在开始的时候增强,之后逐渐减弱。信号增强是因为核染色剂必须与DNA结合,这一结合过程需要一定的时间。另一方面,SPY-650-DNA信号减弱是因为细胞核解体,解体现象见相关图像。
其他信号要么随时间增加而增强(CellEvent™),要么随时间增加而减弱(TMRE):caspase介导的凋亡细胞数量增加的同时激活状态的线粒体数量减少。
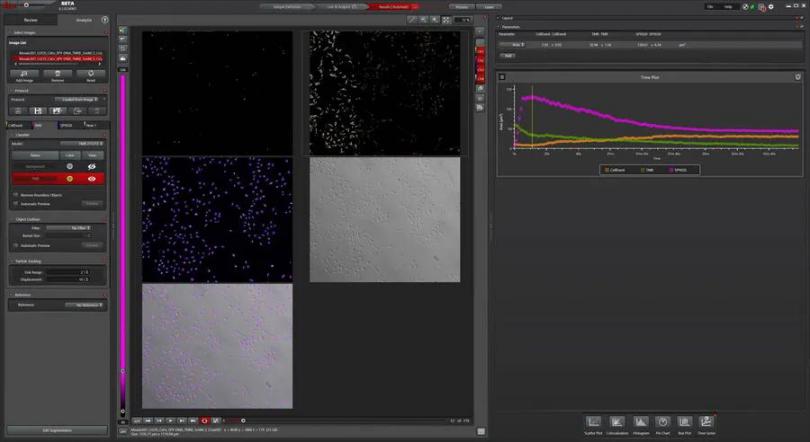
图4:三色caspase 3/7活性检测法量化研究。通过像素分类器检测细胞核、TMRE和caspase阳性细胞,以确定在不同浓度的星形孢菌素下,随着时间的推移发生caspase介导的凋亡的细胞数量。TMRE信号能反映线粒体的健康状态。结果可以多种形式展示,比如时间序列图。
用户可以通过MICA一次性对四种荧光成像。在caspase 3/7活性检测法中,这有助于调查凋亡过程中额外的细胞成分的命运—实现100%时空相关性。图5中展示的案例显示,除了细胞核(DAPI)、激活状态的线粒体(TMRE)以及caspase阳性细胞(CellEvent™)以外,也对肌动蛋白细胞骨架(SiR-Actin)进行了染色。
高倍率下(63x),用户能够看到,caspase被激活之后,肌动蛋白细胞骨架坍塌。与此同时细胞核以及线粒体停止工作。因为所有通道都是在一次拍摄中获得的,各细胞活动成像之间存在精确联系。
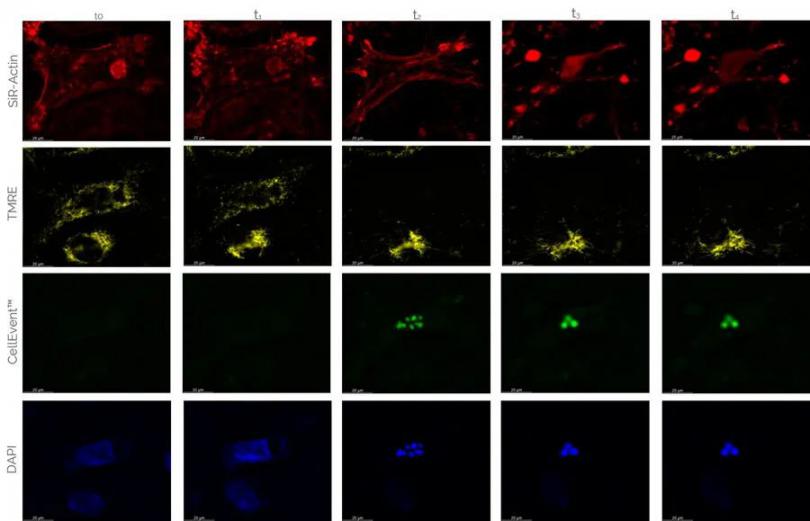
图5:四色caspase-3/7检测,用SiR-Actin、TMRE(线粒体活性)、CellEvent™(caspase活性)以及DAPI(细胞核)标记U2OS细胞。在时间点0加入星形孢菌素。在63x高倍、宽场模式以及THUNDER(ICC)成像模式下获得的图像。
结 论
Caspase活性检测法为研究抗 癌药物提供了新的见解。为了实现这一目标,研究人员必须在保证高时空精 准度的情况下将活细胞从凋亡细胞中区分出来。
对于统计上可靠的结果,增加量很有必要。这就是为什么这类实验必须在孔板上进行,也必须进行量化研究。
MICA满足以上全部要求。在FluoSync的帮助下,MICA可同时保证多达4种不同的荧光染料可以同时成像,不论是在单一培养皿上,还是在96孔板上。MICA完整的培养系统能够培育活细胞数日,同时其自带的基于人工智能的分析功能也有助于用户获得可靠的数据。
参考:
FluoSync - a Fast & Gentle Method for Unmixing Multicolour Images, Science Lab, Leica Microsystems (leica-microsystems.com)

 评论
评论