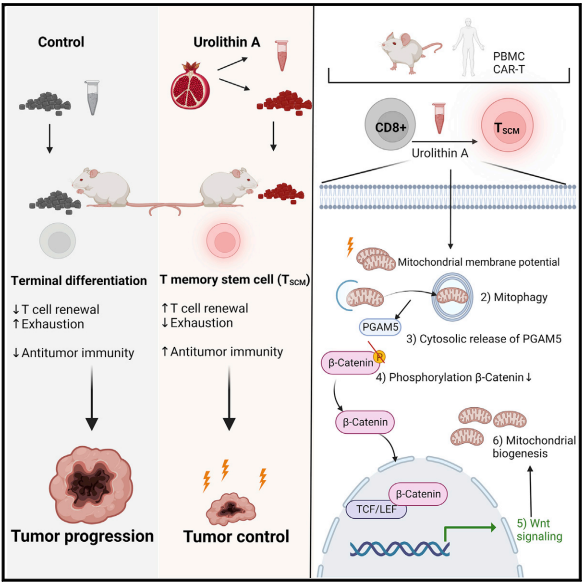
近期,德国 Georg-Speyer-Haus 肿瘤生物学和实验治 疗研究所的研究人员在免疫学领域顶 级期刊《Immunity》上发表了题为“Expansion of T memory stem cells with superior anti-tumor immunity by Urolithin A-induced mitophagy”的研究论文。抗肿瘤免疫会受到 T 细胞持久性和抗原呈递减少的限制。Denk 等人发现,石榴提取物的天然代谢物尿石素 A(Urolithin A)可以增强肿瘤中的抗原呈递,促进 CD8+ T 细胞的自噬,从而产生具有增强抗肿瘤特性的再生干细胞样记忆细胞(TSCM)。
实验结果
01
UA 以 T 细胞依赖性的方式抑 制肠肿瘤生长
为了研究 UA 依赖性自噬是否模仿了 Stat3△IEC 小鼠的效果,并以 T 细胞依赖性的方式阻止了肠道肿瘤的发展,研究者们采用了氧化偶氮甲烷 (AOM)诱导的肿瘤发生模型。FVB 小鼠每周注射一次致癌物 AOM,持续 6 周,并以含 UA 的饲料(2.28 g/kg)或对照饲料喂养 18 周(图 1A)。口服 UA 可显著降低肿瘤发生率和肿瘤大小(图 1B-1D)。随之而来的是 CD3+ T 细胞浸润到结肠黏膜的增多(图 1E 和 1F)。结合肿瘤类器官 APTK 类器官 (characterized by loss of Apc,Trp53,and Tgfbr2 as well as expression of oncogenic KrasG12D)系统实验 ,证实了 UA 诱导的肿瘤抑 制依赖于 T 细胞。
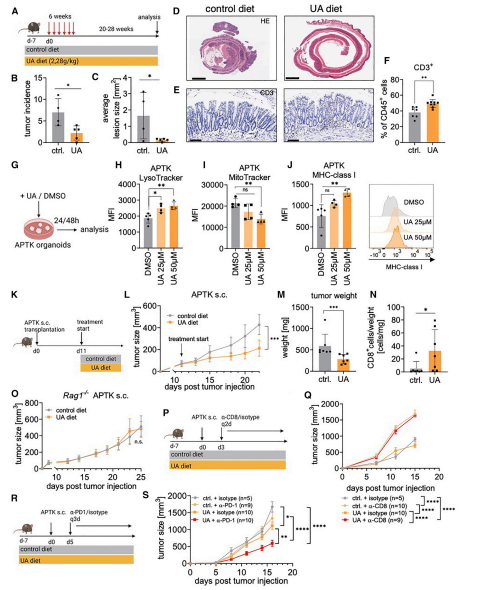
图 1
02
UA 促进 TSCM 分化
线粒体重塑与 T 细胞命运的改变有关。考虑到 UA 效应对 CD8+ T 细胞的依赖性,研究者们想了解 UA 是否也可能直接影响 T 细胞的命运。从 FVB 小鼠中纯化的 T 细胞被 αCD3/αCD28 珠刺激,诱导 T 细胞分化为效应 T 细胞亚群,无论 UA 存在与否,持续 72 小时。UA 给药阻断了向效应 T 细胞的分化(图 2B 和 2C),并导致幼稚 CD44loCD62Lhi T 细胞显著增加。此外,还观察到中 枢记忆细胞(TCM)的减少,而效应记忆细胞(TEM)的频率保持不变。在 CD4+ 细胞中,只观察到较晚时间点的变化,其特征是 CD4+ 细胞的幼稚样减少,但 TEM 细胞的频率增强。
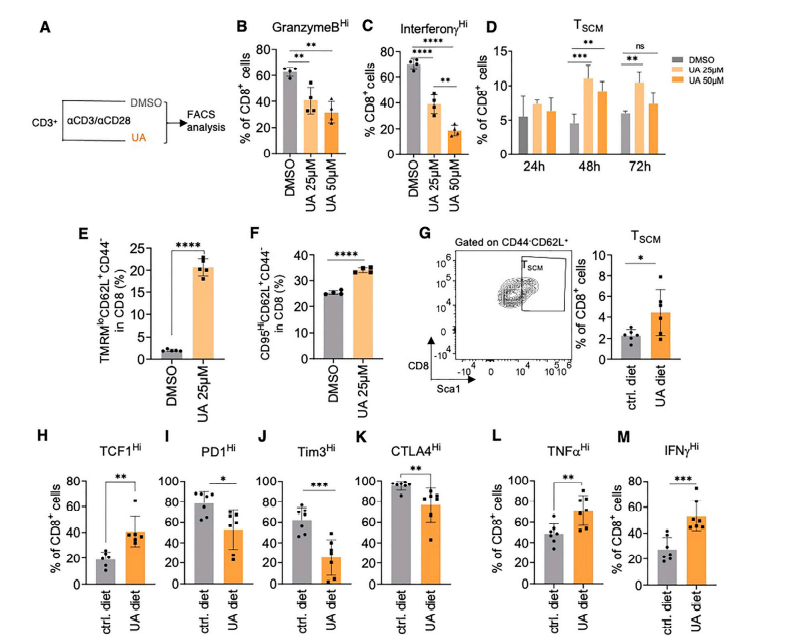
图 2
03
UA 通过过继 T 细胞转移改善肿瘤治 疗
研究者们从 OT-1 供体小鼠(图 3A)中培养 T 细胞 48 小时(UA 或对照),然后过继转移到免疫缺陷 Rag1-/-小鼠。移植后 7 天,在接受了 UA 处理的 T 细胞的小鼠中,移植的 CD8+ T 细胞的数量更高(图 3B),支持增加的扩张潜力。此外,当 UA 条件下的 OT-1 T 细胞移植到具有可触及的过表达卵白蛋白 APTK (APTK- ova)肿瘤的小鼠(图 3C),这导致了与对照 OT-I T 细胞相比更强的肿瘤抑 制(图 3D 和 3E)。对肿瘤的分析显示,在 UA-T 细胞转移后,肿瘤中 CD44 表达较低,而 TCF1HiCD8+ 肿瘤浸润 T 细胞数量较高(图 3F 和 3G)。这在肿瘤中符合 UA 诱导的记忆表型的维持,CD62L 表达保持不变(图 3H)。此外,与改善的记忆反应一致,接受 UA 预处理的 T 细胞的动物在TME中包含更少的 Tim3HiPD1Hi 最 终耗尽的 CD8+ T 细胞(图 3I)。因此,UA 在过继细胞转移过程中增强了免疫介导的抗肿瘤记忆。
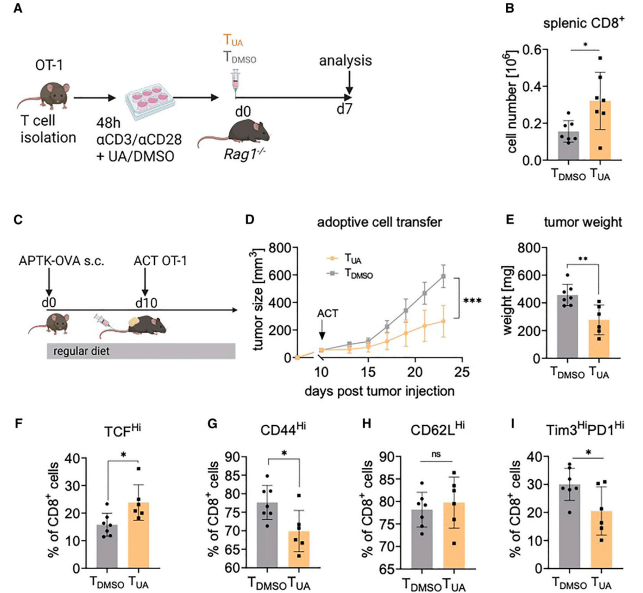
图 3
04
UA 诱导 T 细胞的 Pink1 依赖性自噬
研究者们进一步证实,在给 CD8+ T 细胞服用 UA 后 6 小时内,线粒体膜电位降低(图 4A 和 4B)。这伴随着增强的溶酶体形成(图 4C), 24 小时后,线粒体含量以剂量依赖性的方式丢失(图 4D)。后者可以在所有分析的 T 细胞亚群中检测到,因此提示有丝分裂的诱导。图 4 的其他数据也有力地支持了 UA 诱导的依赖于 Pink1 的自噬触发 TSCM 的形成以增强抗肿瘤免疫的观点。
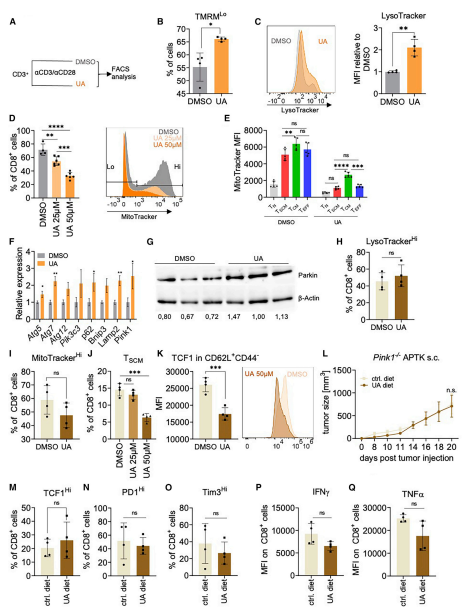
图 4
05
UA 通过 Pgam5 胞质
释放驱动 Wnt 信号诱导 TSCM
研究者们共鉴定出 1178 个差异表达基因,其中 765 个表达上调,413 个表达下调(图 5A)。UA 治 疗降低了免疫检查点和效应分子编码基因的表达,而增强了 Cd27、Ccr7 和粘附基因的表达(图5B),这是干细胞样 CD8+ T 细胞的一个特征。另外,研究了观察到的 TCF1 上调是否是 Wnt 信号增强的结果。根据这一概念,观察到几个 Wnt 靶基因的转录增加(扩展数据图 4B)。此外,UA 在 6 小时后已经导致 β-连环蛋白磷酸化显著下降(图 5),表明 Wnt 信号的激活早于转录因子的改变。图其他结果表明 UA 通过 Wnt 依赖的 PGC-1a 上调来驱动 TSCM 的形成,这是由 Pgam5 在自噬反应中的囊内释放所促进的。

图 5
06
UA 促进人 TSCM 细胞,
帮助产生有效的 CAR - TSCM
最 后,研究者们希望确定UA是否会导致人类 CD8+ T 细胞中 TSCM 细胞的扩增。从健康献血者的外周血单个核细胞(PBMCs)中分离出人 CD3+ T 细胞,并在 UA 存在的情况下体外用 αCD3/αCD28 珠刺激它们。事实上,在 5 / 5 个人供体中,UA 增加了基于 CD45RA+CCR7HiCD62L+CD95+CD8+ 表达的人类 TSCM 细胞的频率(图 6B;图 S5A 和 S5B)。与小鼠 T 细胞一样,UA 处理 48 小时后,人 CD8+ T 细胞显示出线粒体膜电位下降(图 6C),细胞内染色证实 TCF1 表达增加(图 6D),证实 UA 诱导小鼠和人 T 细胞的记忆干细胞特征。为了确定 UA 引发的自噬是否也构成了诱导 CAR-TSCM 的可行策略,在存在或不存在 UA 的情况下,激活的 T 细胞通过慢病毒载体(VSV-LV)转导 CD19-CAR 基因。转导后 3 天,测定 CAR - 表达 TSCM 的数量(图 6E)。UA 不影响基因传递到 CD8+ 细胞;然而,尽管在 UA 暴露后, CAR- 表达的 TSCM 细胞显著增加,约占 CD8+ 细胞的 60%(图 6F),但这对 CD19 CAR- T 细胞介导的 NALM-6 白血病细胞杀伤没有负面影响(图 6G)。即使将 UA 应用于先前冷冻的癌胚抗原特异性 CAR - T 细胞(CEA;图 6H),这种强烈增强的 CAR - TSCM 形成(图 6I)与表达 CEA 的人类 CRC 类器官的杀伤效果相当(图 6J)。因此,UA 显著增强 CAR- TSCM 细胞的增殖。在 CAR T 细胞杀伤实验中,采用了 Molecular Devices 公司的 SpectraMax iD3 酶标仪的发光模式进行了数据读取。
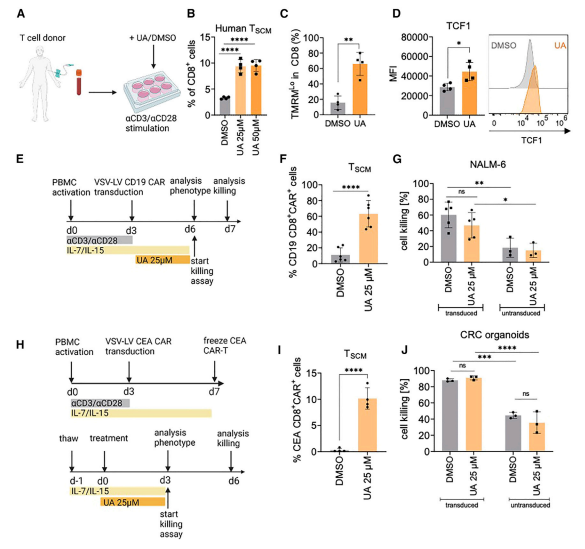
图 6
总结
T 记忆干细胞(TSCM)表现出增强的自我更新能力和延长的生存能力,从而防止 T 细胞衰竭,促进有效的抗肿瘤 T 细胞反应。TSCM 细胞可以被尿石素 A (UA)扩增。(UA)是由肠道微生物群系从富含鞣花丹宁的食物中产生的,已被证明可以改善线粒体健康状态。口服 UA 给荷瘤小鼠提供了强大的抗肿瘤 CD8+ T 细胞免疫,而体外 UA 预处理的 T 细胞在过继细胞转移后显示出更好的抗肿瘤功能。UA 诱导的 TSCM 的形成依赖于 Pink1 介导的自噬触发线粒体磷酸酶 Pgam5 的胞质释放。胞质 Pgam5 去磷酸化 β-catenin,驱动 Wnt 信号通路和代偿性线粒体生物发生。总的来说,研究者们揭示了一个连接自噬和 TSCM 形成的关键信号通路,并认为耐受性良好的代谢化合物 UA 是改善免疫治 疗的一个有吸引力的选择。

 评论
评论