导读
表皮屏障是通过角质形成细胞的干细胞的激活、增殖和分化而恢复的,但其在损伤和老化后通过不明确的机制阻碍了这一修复过程。作者在之前发现了老年小鼠表皮代谢功能障碍的基因特征,但表皮修复和年龄相关生长缺陷的精确调控机制尚未建立。所以作者使用衰老小鼠模型以及代谢调节因子过氧化物酶体增殖物激活受体γ-辅激活物-1α(Pgc-1α)有条件表皮缺失的小鼠,探索控制损伤和应激后皮肤修复的细胞途径。
美国东北大学生物系与加拿大渥太华大学生物化学、微生物学和免疫学系联合研究的研究人员在Molecular Metabolism杂志上发表了题为《Pgc-1α controls epidermal stem cell fate and skin repair by sustaining NAD homeostasis during aging》的文章。文中的H&E染色结果和免疫荧光结果均应用Echo Revolve 显微镜进行显微成像。

研究亮点:
通过ECHO Revolve显微镜对染色的外植体和免疫荧光结果进行成像,得到分辨率高,细节清晰的图像,并结合其他结果的分析发现:
▶ 衰老延缓小鼠伤口再上皮化,与Pgc-1α信号转导降低相关。
▶ 表皮Pgc-1α的缺失减缓了愈合,并由于NAD稳态的破坏而减少了增殖。
▶ 低水平的表皮NAD会增强p53生长停滞,但在补充NAD后会逆转。
▶ 衰老会破坏表皮NAD稳态,但NAD前体可逆转表皮生长缺陷。
文中所有的H&E染色和免疫荧光结果均是使用Echo Revolve Generation 2显微镜进行的快速清晰的成像。揭示了衰老会损伤伤口愈合过程中的表皮再生长,并导致Pgc-1α的表达降低。表皮Pgc-1α有条件缺失的小鼠表现出更大的炎症和UVB诱导的细胞分化、减少的增殖和较慢的伤口愈合。epiPgc-1αKO小鼠还表现出角质形成细胞NAD水平降低、端粒缩短和多聚ADP核糖化增加,导致应激刺激的p53和p21信号增强。当NAD因Pgc-1α缺失或NAD合成的药理学抑制而减少时,应激诱导的增殖减少,分化增加,并通过表皮脱落增强保护DNA免受损伤。同样,老年小鼠表现出表皮NAD稳态紊乱和p53活化增强,导致损伤后p21生长停滞。NAD前体治疗可恢复老年皮肤到年轻皮肤的表皮生长状态。
研究成果:
▼图1证明了与年龄相关的伤口愈合和表皮生长障碍与Pgc-1α信号传导减少有关。

▲ 图1.衰老导致伤口愈合较慢,表皮干细胞生长受损,与Pgc-1α信号传导减少相关。(A)损伤后9天内的伤口闭合(右侧第9天图像)和(B)年轻(4月龄)和老年(24月龄)C57 / Bl6小鼠的角质形成细胞生长。使用结晶紫对(B)中的细胞生长进行染色以便于观察。(C)表皮层分层及其标志物的图解。(D)伤口损伤后5天,年轻和老年皮肤中角质蛋白-14阳性表皮舌的平均长度。(E)损伤后5天,年轻和老年小鼠愈合伤口基础表皮前缘右侧的EdU细胞。(F)年轻和老年小鼠伤口表皮的代表性图像。(G)年轻和老年小鼠表皮中Pgc-1α和Pgc-1β mRNA的qPCR数据。(H)与对照相比,急性UVB暴露后24和48小时,年轻小鼠的表皮Pgc-1α mRNA的表达量。
▼图2证明了表皮Pgc-1α的缺失可减少应激诱导的增殖,增强分化并导致伤口愈合缓慢。
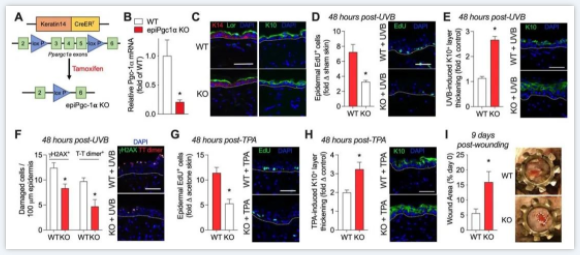
▲ 图2.表皮Pgc-1α的遗传缺失在生理性皮肤损伤后减少细胞生长并增强分化。(A)角质形成细胞中cre-lox重组以删除Pgc-1α的示意图。(B)7–9 WT和epiPgc-1αKO小鼠的表皮Pgc-1β mRNA(Ppargc1a)。(C)角蛋白14(K14)、角蛋白10(K10)和loricrin(Lor)的代表性图像。(D)UVB诱导WT和epiPgc-1αKO小鼠中EdU表皮细胞和(E)K10层厚度相对于对照皮肤的折叠变化。(F)UVB暴露表皮中γH2AX和胸腺嘧啶二聚体的定量,右侧为5 WT和epiPgc-1αKO小鼠的代表性图像。(G)TPA诱导WT和epiPgc-1αKO小鼠EdU表皮细胞和(H)K10层增厚相对于对照皮肤的折叠变化。(I)7–8 WT和epiPgc-1αKO小鼠9天后的开放伤口面积。
▼图3表明Pgc-1α维持表皮NAD稳态,NAD挽救的药理学抑制促进UVB诱导的分化并防止DNA损伤。

▲ 图3.Pgc-1α缺失的角质形成细胞破坏了NAD代谢,对NAD合成的药物抑制足以减少增殖并增强UVB诱导的分化。(A)7–9 WT和epiPgc-1α KO小鼠表皮NAD代谢相关基因的mRNA相对表达。(B)4–5只WT和epiPgc-1α KO小鼠尾部表皮中NAD的相对水平。(C)72小时后,来自年轻皮肤外植体的体外角质形成细胞生长对Nampt抑制剂FK866的剂量反应。(D)C57 / Bl6小鼠中FK866应用与UVB应激相结合的示意图。(E) 对照手术或UVB暴露48小时后,用局部FK866(100 nM)或载体(Veh;乙醇)处理的每组5–6只小鼠的表皮NAD水平。(F)角蛋白10层级增厚。(G)表皮增殖(EdU)的变化,以及(H)γH2AX阳性表皮细胞的丰度。代表性免疫荧光图像(F–H)显示在量化右侧。
▼图4证明了增加Pgc-1a缺失小鼠的NAD水平挽救异常应激诱导的分化并恢复伤口愈合。
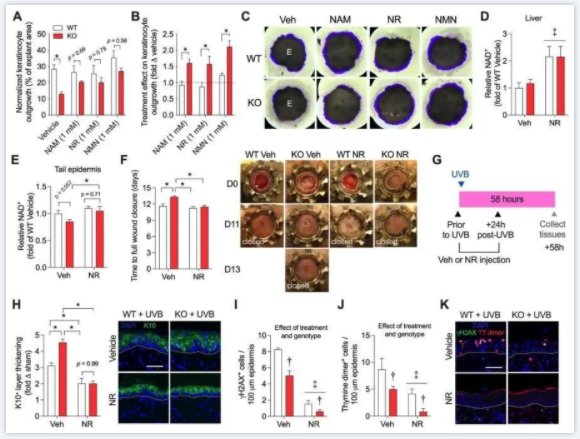
▲ 图4.用NAD前体治疗表皮Pgc-1αKO小鼠可加速皮肤愈合并抑制UVB诱导的分化。(A–B)使用4 WT和epiPgc-1αKO皮肤样品(NAD前体烟酰胺单核苷酸(NMN)、烟酰胺(NAM)或烟酰胺核苷(NR)处理或未处理),角质形成细胞生长为外植体面积的一部分或载体条件的数倍。(C)(A–B)生长出的代表性图像用结晶紫染色,以便于可视化。(D–F)每天注射赋形剂或500 mg/kg NR的4-7 WT和epiPgc-1αKO小鼠的肝脏NAD、尾表皮NAD水平和伤口完全闭合的时间。损伤后第0天(D0)、第11天(D11)和第13天(D13)的代表性图像。(G) UVB暴露和NR剂量示意图。(H–K)用载体或烟酰胺核苷(NR)处理的4只WT和Pgc-1αKO小鼠的UVB暴露表皮中的角蛋白10增厚、γH2AX细胞和胸腺嘧啶二聚体细胞。代表性免疫荧光图像及量化结果。
▼图5证实了Pgc-1α的缺失诱导端粒缩短,增强Parp活性并增强应激诱导的p53信号传导。
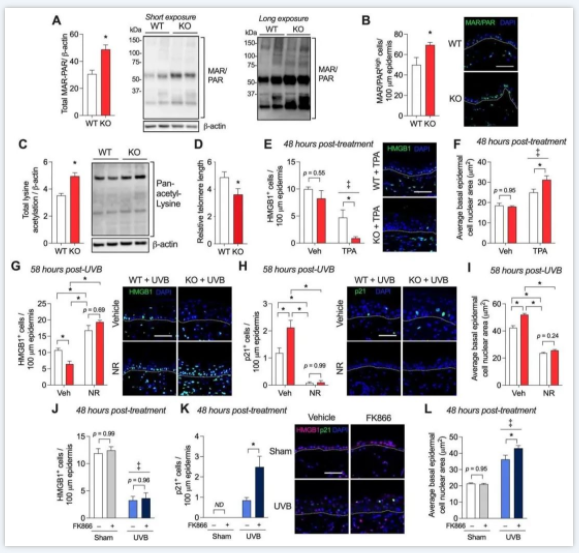
▲ 图5.表皮Pgc-1α缺失后的端粒功能障碍以NAD依赖的方式使干细胞对应激诱导的p53活化和核增大敏感。(A)定量6–7 WT和epiPgc-1αKO小鼠表皮裂解物中多聚和单ADP核糖(MAR/PAR)的免疫印迹。(B)4–6 WT和epiPgc-1αKO小鼠的亮染MAR/PAR表皮细胞数量(MAR/PAR+高)。(C)表皮裂解液中泛乙酰赖氨酸的免疫印迹定量。(D)平均表皮端粒长度。(E)5–6 WT和epiPgc-1αKO小鼠的载体和TPA处理皮肤中的核HMGB1细胞和(F)基底层核大小。(G)用载体或烟酰胺核苷(NR,500 mg/kg)处理的WT和epiPgc-1αKO小鼠58小时后,UVB暴露表皮的核HMGB1或(H)p21表皮细胞以及(I)基底层核大小。(J)用局部载体或FK866处理的6只C57Bl/6小鼠中,对照手术和UVB暴露表皮的核HMGB1或(K)p21表皮细胞以及(L)基底层核大小。代表性免疫印迹(A、C)或免疫荧光图像(B、E、G、H、K)显示在量化右侧。
▼图6老年表皮表现出NAD稳态紊乱和p21生长停滞增加。
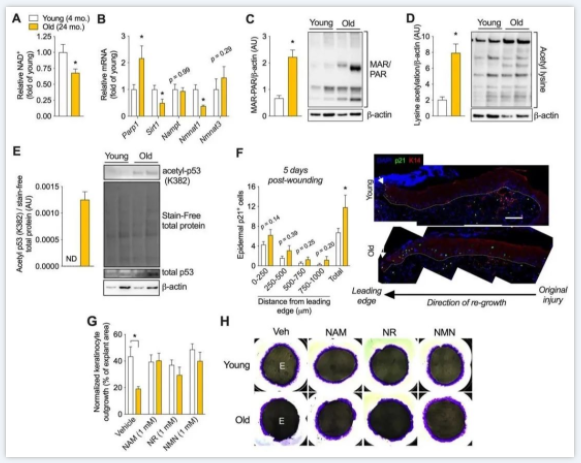
▲ 图6.衰老破坏表皮NAD稳态并增强p53-p21信号轴。(A)年轻小鼠与老年小鼠表皮NAD的相对水平和NAD代谢相关基因的(B)mRNA表达。年轻和老年表皮中(C)MAR/PAR酰化的免疫印迹。(D)赖氨酸乙酰化和(E)乙酰基p53(K382)的免疫印迹,右侧为定量。(F)年轻(4月龄)和老年(24月龄)小鼠损伤后5天,前缘内的表皮p21细胞。右侧的代表性图像,虚线显示了从箭头开始的前缘的前1000μm。(G)用所示NAD前体处理72小时的年轻和老年小鼠的皮肤角质形成细胞外植体生长。
通过ECHO Revolve正倒置一体显微镜的优质成像,得到了所需的高清图片,不仅用于观察分析,还可使用tiff黑白原图进行定量分析,最终得到整个结论。该项研究确定了表皮Pgc-1α通过调节细胞NAD+和对p53驱动的生长停滞的下游影响,在控制表皮修复中的新作用。另外还发现,衰老表皮中存在明显的平行机制,表明NAD信号传导是生理性皮肤修复的重要控制因素,并且该途径的功能障碍导致了与年龄相关的伤口修复缺陷。
期刊介绍:
《Molecular Metabolism》致力于作为一个报告能量稳态以及代谢紊乱(如肥胖、糖尿病、心血管疾病和癌症)的病因、发展、治疗和相关健康后果方面的突破性发现的平台。该杂志发表了以最高标准生成的假说驱动的研究,为对能量稳态相关行为、生理学和功能障碍等机制的理解铺平了道路。最新影响因子8.568。
Revolve Gen 2正倒置一体电动荧光显微镜

新一代Revolve正倒置一体电动荧光显微镜,拥有流行的触屏操控方式,配备智能荧光成像系统,将Z-Stacking全景深成像和DHR数字处理功能有机联合,提升分辨率告别照片模糊,为您打造全新的成像体验。

 评论
评论