脊髓损伤(spinal cord injury, SCI)是对脊髓造成的暂时性或永 久性的功能性损伤,常见的症状包括肌肉、感觉或自主神经功能的丧失。
在严重的SCI后,神经炎症失调会导致神经元和神经胶质细胞凋亡,在伤口愈合过程中形成疤痕和空腔,并最终形成抑制神经再生的萎缩性微环境。由于涉及到复杂和动态的病理生理学情况,少有通过微环境重塑实现无疤痕和无腔伤口愈合从而促进神经再生的系统解决方案。2021年7月10号,来自于浙江大学医学院的研究团队。在Advanced Healthcare Materials上发表了题为Rationally Designed, Self-Assembling, Multifunctional Hydrogel Depot Repairs Severe Spinal Cord Injury的文章,研究团队研发了一种新型水凝胶,搭载抗炎药物MPSS和GFs,促进瘢痕边缘和空腔愈合,可显著促进轴突再生。

▲论文图
研究结果分析
01首先,研究团队设计并制作了水凝胶
为了填补SCI后不规则的病变区域,研究团队设计了一种可注射、可搭载各种治疗剂的自组装凝胶(HD)。该水凝胶具有亲水性、蛋白粘性以及增加细胞间的相互作用等特性。测定水凝胶冻干样品在2个月内质量损失,结果发现在SCI慢性期后注射该水凝胶可支持细胞迁移。同时,溶胀研究结果发现,该水凝胶适合注射到SCI部位,不会引起注射后的二次损伤。
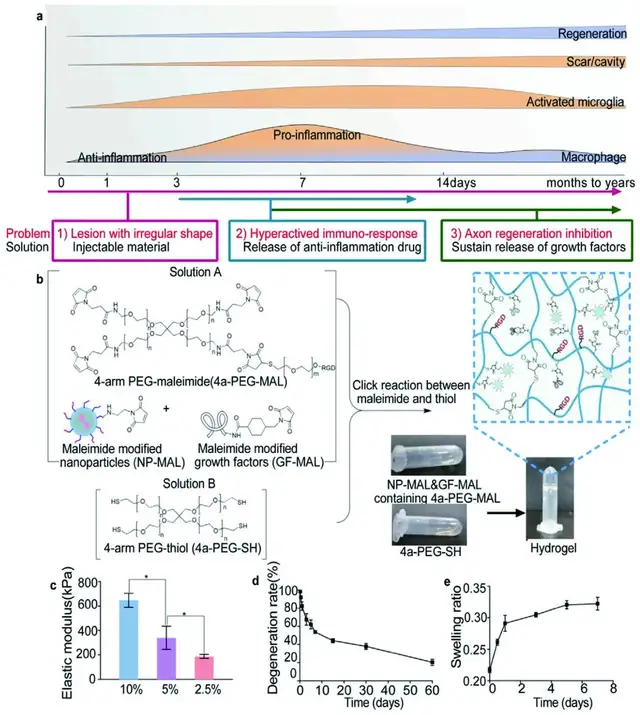
▲Fig. 1.1
02抗炎药物与生长因子释放曲线的优化
为了改善SCI急性期产生的炎症,研究人员将抗炎药物MPSS包埋进纳米颗粒(NPs)中,将药物释放时间延长至几天,保证抗炎药物在急性期内发挥最大功效。结果显示,传统没有纳米颗粒材料搭载的情况下,MPSS释放时间约为2天;而有纳米颗粒材料搭载的MPSS释放时间长达4-7天,可覆盖SCI急性期。
利用点击化学方式将生长因子(GFs)缀合到水凝胶中,释放时间可长达1个月,在SCI慢性期可为神经再生提供有力的支持。评估生物相容性的结果显示,在水凝胶培养基中培养的细胞与在常规培养基中培养的细胞活力相当,表明水凝胶具有生物相容性,细胞毒性低。

03仅使用生长因子的水凝胶不足以完全防止空腔和瘢痕边界形成
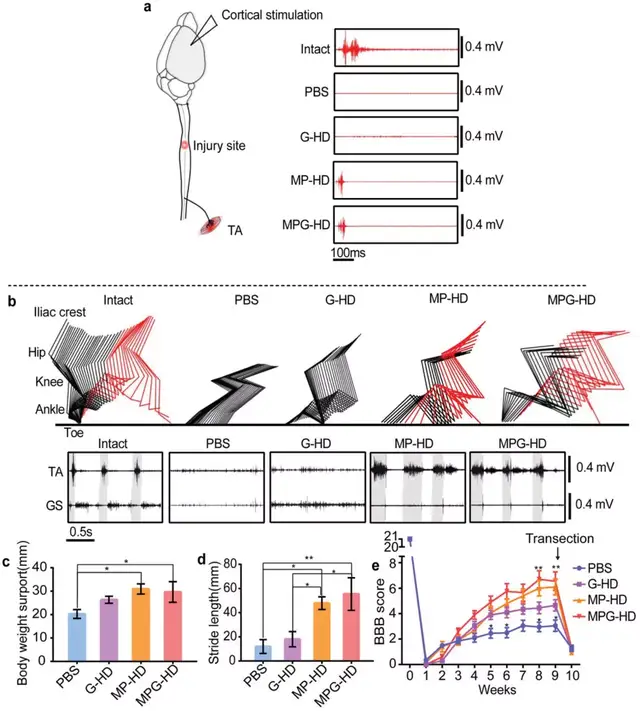
生长因子如BDNF,可显著提高SCI后神经元的存活率,研究团队进一步探究了水凝胶仅缓释生长因子是否会优化神经元/组织的保护效果。首先,使用RWD 68099II 打击器,对大鼠T10节段采用打击速度2m/s,深度2 mm,停留时间为5 s的打击方案来模拟临床SCI 。SCI损伤后的大鼠BBB评分为 0 到 2,说明几乎无轴突存活。
实验组(G-HD)在SCI一周后的损伤部位注入搭载BDNF、VEGF以及bFGF的水凝胶,对照组注入PBS溶液。8周后,3D图像量化结果显示 G-HD 组的空腔体积约为对照组的一半,不规则病理组织的体积增加了一倍,残余组织量相比对照组也显著增加。然而G-HD组在宿主/材料界面处仍然形成GFAP+“墙”,可能是因为 G-HD 组并没有减轻脊髓炎症反应。即单独使用水凝胶长期释放生长因子可以支持神经元/组织存活,但不能完全防止空腔和瘢痕边界形成。
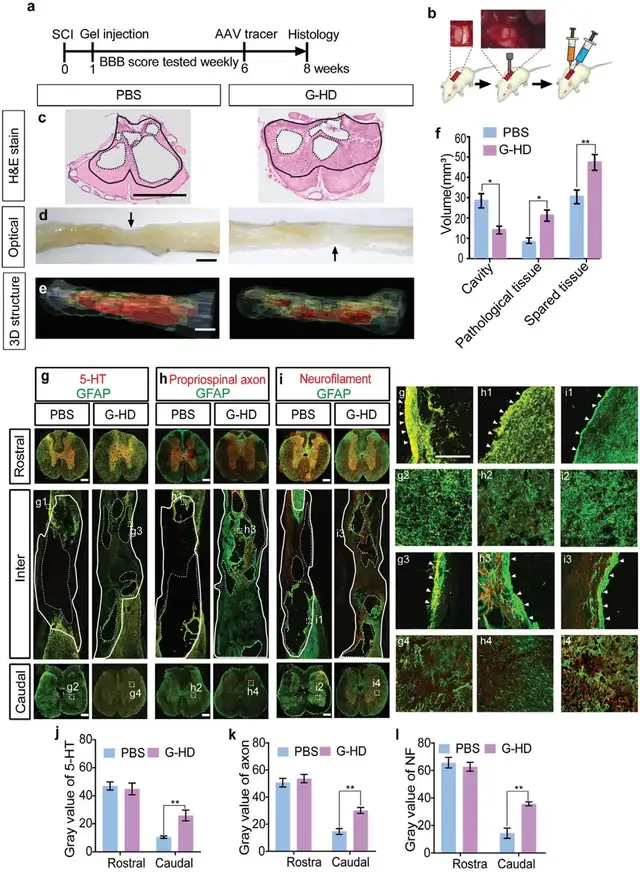
▲Fig. 2
04搭载抗炎药的水凝胶几乎可以完全防止空腔形成,但无法抑制瘢痕的形成
由于生长因子无法有效阻碍空腔形成,研究团队尝试通过延长抗炎药物释放时间,缓解脊髓炎症反应,从而防止空腔形成。将MPSS(M-HD组)和纳米颗粒搭载的MPSS(MP-HD组)分组注射在患处。对比发现,MP-HD组的空腔体积仅为M-HD组的1/7,MP-HD组几乎可以阻止空腔形成。损伤处下方的NF+ 轴突密度是对照组的两倍。由于 MP-HD 组几乎可以完全防止 SCI 后空腔形成,通过评估空腔的体积和剩余轴突的数量来确定介导过度活跃的神经炎症以防止空洞形成的最佳时间窗口。结果表明SCI 后 3-7 天可能是调节失调的神经炎症和保护神经元/组织的最佳时间窗口。

▲Fig. 3
05水凝胶协同释放生长因子和抗炎药物,促进神经再生
尽管 MP-HD 组几乎完全阻止了空洞的形成,但疤痕边界仍然抑制了受损轴突的再生。研究团队推测,除了抗炎药外,提供神经营养因子可能会促进神经元/组织的存活并减弱瘢痕的形成。在损伤后第 7 天,将含有MPSS装载的NPs和GFs的水凝胶(MPG-HD)注射到损伤部位。与 MP-HD 组相比,MPG-HD组几乎完全阻止了空腔的形成并保护了大量幸存的组织/轴突免受二次损伤,致密的GFAP+“墙”在MPG-HD介入后基本消失,新生一些较松散的结构,可能是因为生长材料促进了细胞存活并增强了材料和宿主组织的整合。MPG-HD组伸入病灶 2 mm 的 NF+ 轴突数量增加了两倍但这些轴突并没有延伸到损伤部位的中心。总的来说,MPG-HD治疗挽救了一些幸存的轴突免于继发性损伤,并为轴突再生建立了一个可能的环境,即使这些轴突没有穿过损伤部位。
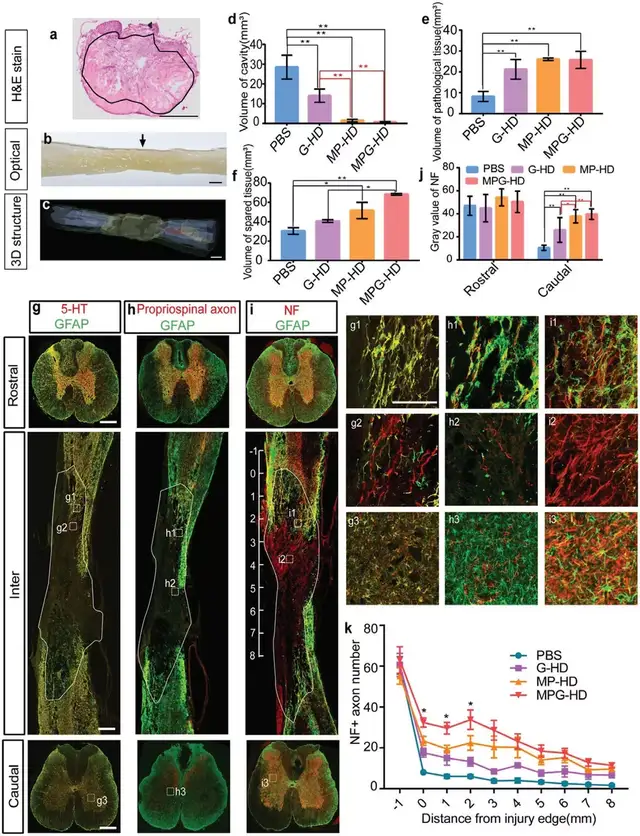
▲Fig. 4
06MPG-HD 治疗通过 ECM 重塑促进神经再生
研究团队进一步探究了MPG-HD防止空腔/瘢痕边界形成并促进神经再生的机制。
横向脊髓切片的 GFAP 和纤连蛋白 (FN) 染色表明,PBS对照组动物中形成的空腔大部分被 FN+ 基质填充。MP-HD 和 MPG-HD组的脊髓中的 Iba1 和 CD68 免疫反应强度显著降低至与完整组织相当的水平,表明 MP-HD 和 MPG-HD 成功将炎症诱导的神经毒性调节至正常水平。仅在 MP-HD 或 MPG-HD 治疗后在损伤中心区域观察到更多的神经元和髓鞘,表明 MP-HD 和 MPG-HD 治疗后防止了轴突切断的脊髓神经元和少突胶质细胞的死亡。在MPG-HD 组中神经元、成纤维细胞、少突胶质细胞和内皮细胞的比例有所增加,表明 MPG-HD 有助于组织保护和 ECM 形成;另一方面,炎症相关细胞的比例有所减少,表明 MPSS 的释放可以抑制 SCI 后的神经炎症;同时,负责在受伤和完整组织之间形成屏障的小胶质细胞的比例呈下降趋势。
研究人员进一步关注了在SCI伤口愈合过程中发挥抗炎和促炎作用的巨噬细胞,MP-HD 和 MPG-HD注射后抗炎巨噬细胞比促炎巨噬细胞多,且在MPG-HD注射条件下抗炎基因表达增加,促炎基因表达下降。此外,与伤口愈合、髓鞘、ECM、胶原蛋白和 GF 结合以及细胞粘附相关的基因表达在MPG-HD组比PBS对照组中显著富集。这些结果表明MPG-HD治疗优化了ECM形成并促进组织保护。
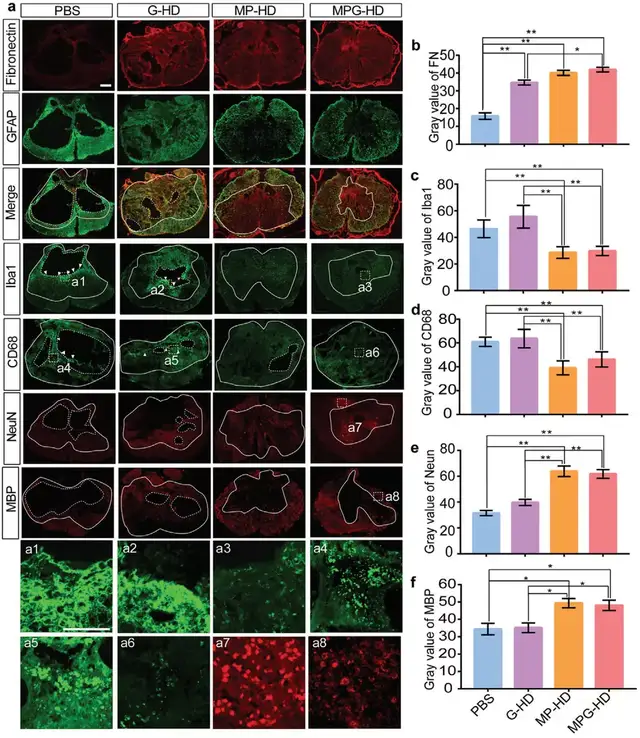
Fig. 5
07水凝胶通过治疗幸存轴突而非再生轴突来促进功能恢复
在功能和行为方面,第5 周时,G-HD 组大鼠可见明显的踝关节运动,并在注射9 周后达到功能平台。MP-HD 组7周后大鼠可见足底踏地和负重步行,表明 MP-HD 治疗具有防止空腔形成和保护备用幸存组织/轴突的能力。然而,与 MP-HD相比,MPG-HD 治疗未能进一步改善功能恢复,表明 MPG-HD 治疗诱导的再生轴突不能自发发挥功能。
08残留的轴突支配损伤部位下方的脊髓并介导功能恢复
为了确认残余的轴突重新支配了损伤部位下方的脊髓神经回路,使用肌电图 (EMG)评估从中 枢神经元到外周神经元的连接。将刺激电极放置在后肢运动控制区的皮质上,并监测踝屈肌的EMG活动,发现仅在 MPG-HD 组的动物中观察到踝屈肌的EMG 活动,但幅度小于未损伤动物的幅度。为了进一步确认功能恢复是否依赖于残留的神经元回路,研究人员将脊髓损伤部位重复横断,一周后后肢功能改善完全消失,该结果表明,功能恢复是由剩余的轴突依赖性神经元回路介导的。
展望
在本研究中,再生轴突不能穿过病变部位到达运动功能束。理想情况下,具有精确线性阵列的自组装支架可以帮助轴突经由脊髓病变部位向适当的目标区域再生,但是目前还没有这种技术。在未来的研究中,原位 3D 打印技术可能能够在脊髓病变上创建精确、高保真的线性阵列。即使损伤的轴突可以在病变处生长,它们可能仍然难以触及靶点,并且它们可能需要依赖于使用可塑性来形成中继电路并整合到功能网络中。
瑞沃德68099II精密打击器是一款用于颅脑和脊髓损伤造模的仪器,采用气动-电动控制,可精 准调节打击速度、打击深度以及停留时间,实现精 准打击。

* 戳这里查看文献原文https://img03.en25.com/Web/RWD/%7B263c58db-a399-4dd3-8957-90237686bbb3%7D_Depot_Repairs_Severe_Spinal_Cord_Injury.pdf

 评论
评论