在悬浮阵列技术中构建大容量光学条码的一个严重障碍是能量转移,这会导致不可预测的条码信号、有限的条码数量以及不可行的实验迭代次数。这项工作报告了一种有效且简单的方法来消除多色中的能量转移
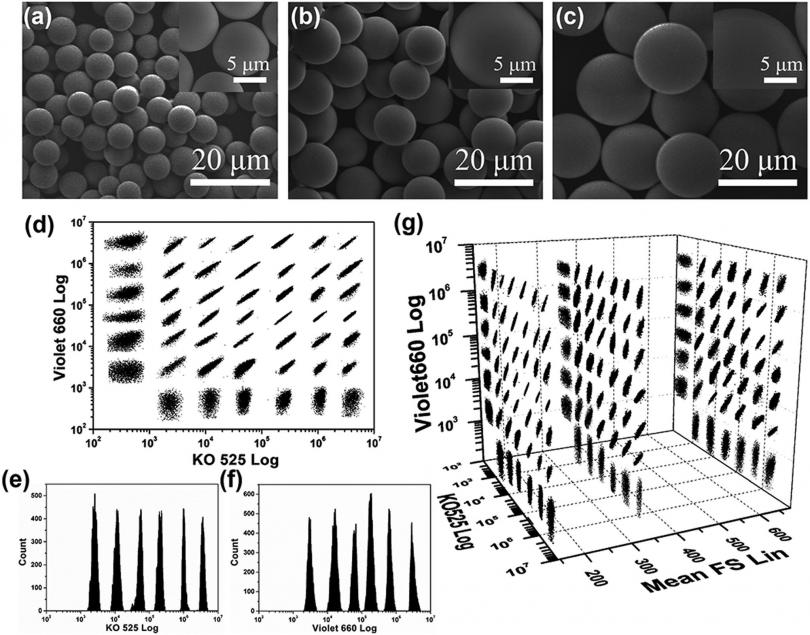
通过结合具有大斯托克斯位移(约 180 nm)的四足 CdSe/CdS QD 来构建量子点 (QD) 编码的微珠。利用这一独特的功能,可以轻松实现理论上的 7×7-1 条码矩阵,该矩阵结合了两种颜色和七种强度级别。因此,含有四足体 CdSe/CdS QD 的微珠被证明具有强大的编码能力,可以实现精确的条形码设计。 Shirasu 多孔玻璃膜乳化方法能够轻松控制微珠大小,有助于建立包含 144 个可区分条码的 3D 条码库,显示出实现大规模多重检测的巨大潜力。此外,当应用于五种常见过敏原的多重检测时,这些条形码表现出优异的检测性能(检测限:0.01–0.02 IU mL-1)
适用于加标和患者血清样品。因此,这种新的编码策略有助于扩大条码容量,同时降低用于高通量复用检测的微珠光学编码的技术和经济障碍。

一、简介
基于编码微珠的悬浮阵列技术 (SAT) 在单个小样本体积内的分析物多重检测中发挥着重要作用,使其广泛用于单细胞分析、蛋白质分析、基因分析和早期疾病诊断和编码微珠是 SAT 的重要组成部分,因为它们具有用于检测特定目标的可靠支持和跟踪代码。因此,实现高通量复用检测需要足够数量的条码。 当前的光学编码策略通常结合颜色和强度,以实现灵活编码和高速解码 是最与其他许多编码方法(例如图形编码、物理编码、化学编码和电子编码)相比,这种编码方法更为普遍。 光学编码策略通常利用荧光团 [例如有机染料、量子点 (QD)],它们发出两种或更多颜色以实现更多条码。
然而,多色荧光团之间的光谱重叠不可避免地会产生难以处理的整体荧光现象,例如随机 Förster共振能量转移 (FRET) 和光子重吸收,导致非正交荧光响应。因此,这限制了条码的数量,并使获得的条码信号难以预测或设计,即使在微珠中加入了准确比例的荧光团。因此,获得足够数量的可区分条码需要大量的实验迭代,由于构建高容量多路复用检测平台的技术和经济进入壁垒,这是许多科学家无法实现的选择。
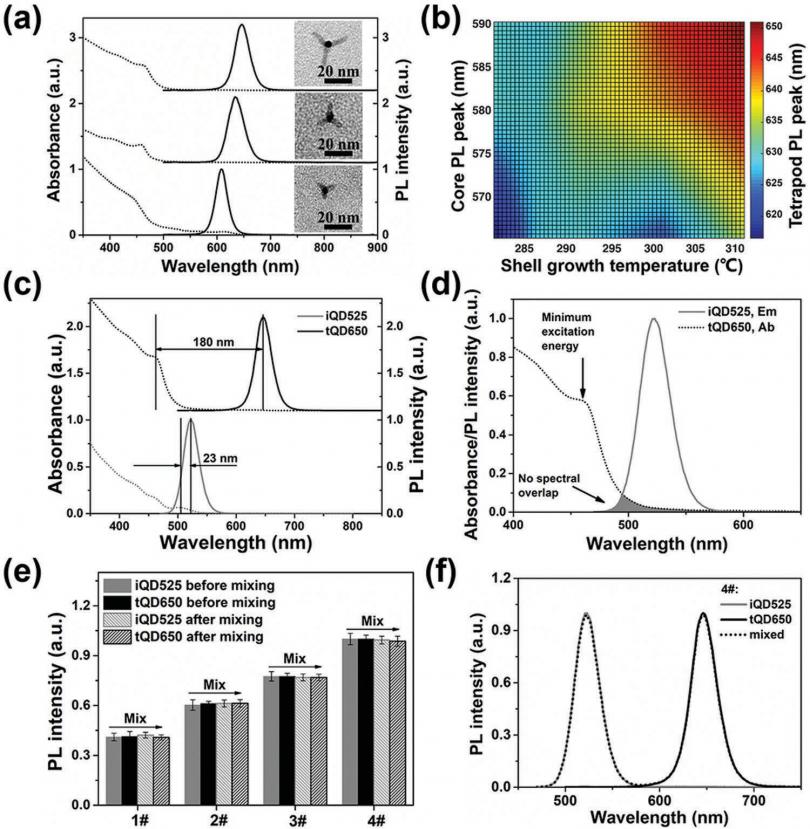
总之,我们报告了一种有效且简单的方法来消除多色 QD 编码微珠中的能量转移
通过结合具有大斯托克斯位移的四足体 CdSe/CdS QD。在这些四足体 CdSe/CdS QD 中执行如此大的斯托克斯位移(约 180 nm),其发射峰位于 650 nm,能够有效抑制 tQD650 的吸收光谱和 iQD525 的发射光谱之间的光谱重叠。因此,我们应用此策略通过 SPG 膜乳化方法通过结合特定比例的 iQD525 和 tQD650 来指导多色 QD 编码的微珠的生成,它们没有光谱重叠。这使我们能够通过构建结合两种颜色和七种强度级别的理想 7×7-1 条码矩阵来消除能量转移并率先采用创新方法进行精确条码设计。由于 SPG 膜乳化方法也可以控制微珠的大小,我们建立了一个结合颜色、强度和直径作为编码元素的 3D 条码库,产生了 144 个可区分的条码,展示了我们编码策略的强大编码能力,并表明其在大规模多重检测方面的潜力巨大。此外,QDs 编码的条形码在五种常见过敏原的多重检测中表现出良好的性能。
gens (LOD: 0.01–0.02 IU mL-1)。我们的概念验证工作为构建高容量多路复用平台提供了更大的可访问性,迄今为止,该平台的标志是减少了大量技术和经济障碍,例如不可预测的条码信号、有限的条码数量以及大量实验迭代的需要.此外,我们希望本文提供的结果将有助于解决使用多色荧光团混合物的其他应用中的能量转移问题的通用解决方案。还需要注意的是,如果我们能够进一步提高非特异性生物污染抑制、生物分子的定向固定和开发“即时护理”诊断,基于编码微球的悬浮阵列将更加强大和稳健平台。
点击下载
 徕卡电子显微镜镀膜技术简要介绍
徕卡电子显微镜镀膜技术简要介绍
 钙钛矿太阳能电池镀膜技术详解
钙钛矿太阳能电池镀膜技术详解
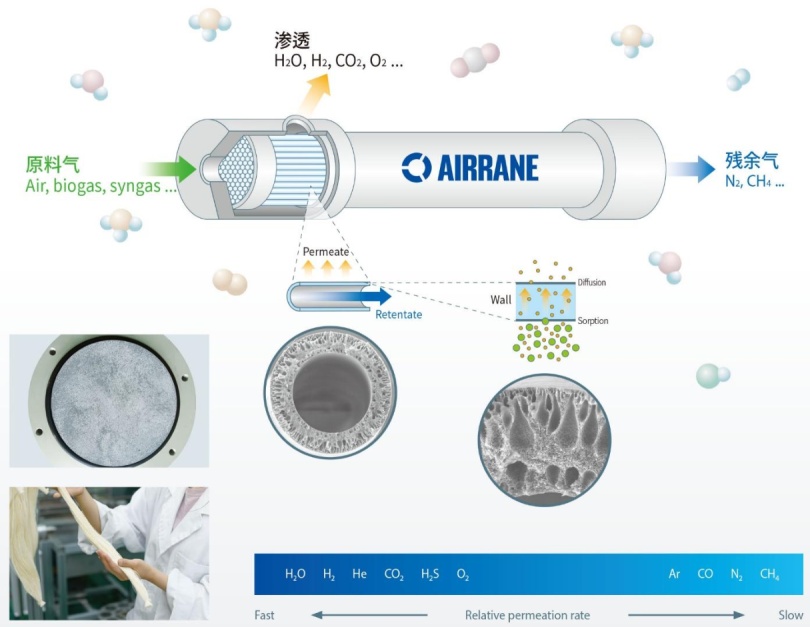 分离膜技术原理
分离膜技术原理

 评论
评论