摘要
纳米颗粒药物递送系统通过增加特定部位的药物浓度并解决小分子药物的低溶解度、低特异性和快速清除小分子药物而被广泛的应用于提高疾病治愈的效率。严格控制和可预测的纳米颗粒大小、分散度和载药量对药物动力学和药效学功效至关重要。但是,高水平且可重复性的制备复杂的纳米颗粒并非易事。该研究描述了一种基于流量和流量比的高精度调节,以可控、可重现和有效的方式产生载有药物的纳米水凝胶的微流控方法。作者证明了载有药物的纳米水凝胶的细胞吸收,随时间的药物释放并评估了对细胞的潜在治愈作用。
引言
ZL慢性疾病的主要挑战是确保药物的靶向递送和持续释放,从而避免小分子从体内自然快速的清楚并发展出多耐药性[1]。纳米颗粒载药系统是一种增加组织在药物中的保留时间并控制药物释放速率,提高治LX果并最小化所需给药频率的有前途的一个策略[2]。这些载体充当封装药物的“Trojan
horse”防护罩,也可以在它们的表面上进行功能化然后将纳米颗粒靶向定位到特定组织。
由于通过微毛细血管循环的预期递送途径,纳米颗粒疗法通常被分类为直径100nm或更小,但也可以指较大的颗粒。直径为200
– 500
nm的颗粒可以在眼睛的玻璃体凝胶中自由扩散[3],在这种情况下,对于药物输送制剂而言其仍然是一种可行的尺寸。为了实现持续的药物释放和临床可靠性,人们必须严格控制纳米粒子的大小分布和载药量[4]。传统的批量制备方法依靠剧烈搅拌和纳米沉淀,不足以控制所形成粒子的大小或分散性[5]。
微流体技术由于能够通过微米尺寸的通道精确控制微升体积的流速和流量比,因此特别适合于纳米颗粒的制备。适用于纳米颗粒形成的微流控芯片具有不同的几何形状,包括T型结构、毛细管、流体动力聚焦(十字型结构)、人字型及其他微混合芯片[5,6]。微流控技术的结果是对空间分离、反应时间、纳米颗粒混合和沉淀的高度控制,包括更均匀的尺寸分布和改进的药物加载控制。
目的&目标
● 用微流控技术产生载药纳米水凝胶
● 测试载有药物的纳米水凝胶进入细胞并评估药物释放
● 研究药物功效(对细胞的潜在抗血管生成作用)
主要发现
Hyaluronic
acid
(HA,透明质酸)被用作载体,因为它在玻璃凝胶中含量丰富,并且具有许多适合官能化的反应性基团(例如,在本研究中,具有RGD图案用于靶向细胞表面整联蛋白)。作者合成了一种对离子强度敏感的新HA衍生物,并利用其在微流体混合过程中添加盐时凝聚的倾向来产生纳米颗粒。
这项研究采用了与Elveflow的OB1压力驱动型流量控制器和流量传感器相连接的分体重组微混合器芯片,以精确控制芯片中不同流体的流速和流量比。根据所用聚合物与盐溶液的流量比,形成了具有低多分散性的直径为150~450
nm的纳米水凝胶颗粒(在优化过程中,测试了0.05 – 0.5的比率)[7]。
相比之下,使用传统的批处理方法产生的颗粒尺寸和分布更大[7]。使用聚合物与盐的流量比为0.1时,所产生的纳米水凝胶的多分散性较低且受到严格调节(图2)。

图1 用于药物递送的纳米水凝胶的微流体制备:实验装置。由Fabio Salvatore Palumbo提供。
官能化载体加Imantinib溶液与盐溶液(流量比为0.1)的精确微流混合产生了可重载9%(w/w)的纳米水凝胶。与溶液中的游离药物相比,观察到该药物在48小时内从纳米水凝胶释放的延迟曲线,这表明微流体制备的输送系统适用于药物输送。
测试了载药纳米水凝胶对培养细胞的作用。线粒体活性分析表明,带有或不带有药物的纳米水凝胶对HUVEC
或 HRPEpiC
cells没有细胞毒性,荧光标记的追踪表明载体已被细胞大量吸收。观察到的YZ的细胞管组织和稳定性进一步表明了释放的Imantinib的抗血管生成潜力,表明内皮细胞定向、迁移和发芽受到破坏。
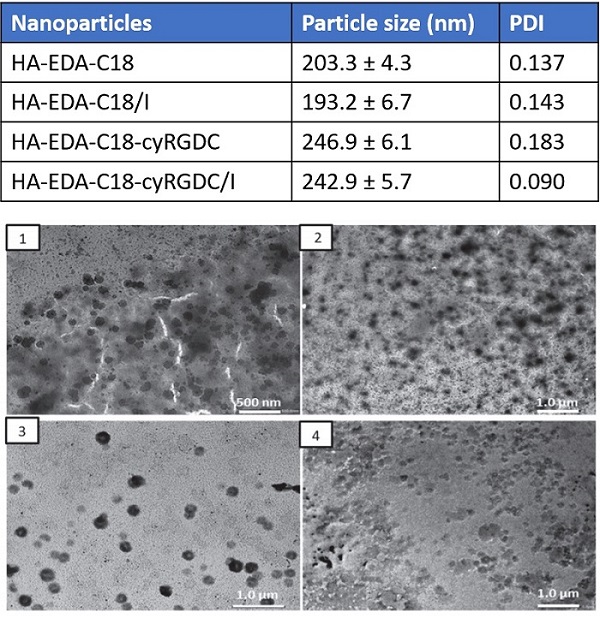
图2 用于药物递送的纳米水凝胶的微流体制备。由Fabio Salvatore Palumbo提供。
结论
作者使用精确的压力驱动的流量控制微流体来部署一个实验平台,其可重复的产生具有所需尺寸和低多分散性的纳米水凝胶以及如药物输送系统所需的一致的载药量以实现可预测的药物释放。
参考文献
[1]
Zahedi, P., Yoganathan, R., Piquette-Miller, M., and Allen, C. (2012)
Recent advances in drug delivery strategies for treatment of ovarian
cancer. Expert Opin. Drug Deliv. 9, 567-583.
[2] Peer, D., Karp, J.,
Hong, S., Farokhzad, O.C., Margalit, R. and Langer, R. (2007)
Nanocarriers as an emerging platform for cancer therapy. Nature Nanotech
2, 751–760.
[3] Guter, M. and Breunig, M. (2017) Hyaluronan as a
promising excipient for ocular drug delivery. Eur. J. Pharm. Biopharm.
113, 34–49.
[4] Singh, R. and Lillard Jr, J.W. (2009) Nanoparticle-based targeted drug delivery. Exp. Mol. Pathol. 86, 215-223.
[5]
Ma, J., Lee, S.M.-Y., Yi, C. and Li, C.-W. (2017) Controllable
synthesis of functional nanoparticles by microfluidic platforms for
biomedical applications – a review. Lab Chip 17, 209-226.
[6]
Stroock, A.D., Dertinger, S.K.W., Ajdari, A., Mezić, I., Stone, H.A. and
Whitesides, G.M (2002) Chaotic Mixer for Microchannels Science 295,
647-651.
[7] Agnello, S., Bongiovì, F., Fiorica, C., Pitarresi, G.,
Palumbo, F.S., Di Bella, M.A., Giammona, G. (2017) Microfluidic
fabrication of physically assembled nanogels and micrometric fibers by
using a hyaluronic acid derivative. Macromol. Mater. Eng. 302, 1700265.
NOTE:
本文简要介绍了采用微流控技术产生用于药物递送应用的纳米水凝胶。参考文献“Flavia
Bongiovì, Calogero Fiorica, Fabio Salvatore Palumbo, Giovanna
Pitarresi and Gaetano Giammona, Hyaluronic acid based nanohydrogels
fabricated by microfluidics for the potential targeted release of
Imatinib: Characterization and preliminary evaluation of the
antiangiogenic effect, the International Journal of Pharmaceutics, Jan.
5, 2020”
 转化医学系列网络讲座预告|仿生纳米药物用于人脑胶质瘤的ZL
转化医学系列网络讲座预告|仿生纳米药物用于人脑胶质瘤的ZL

 评论
评论