随着我国仿制药一致性评价工作的持续深度推进,越来越多药企加紧试验研发工作,相继完成评审,顺利通过这一轮严格的ZG医药行业大洗牌。但也有部分药企在研发试验阶段由于工艺、技术等导致药物出现问题,这其中就有大家熟悉的由NDMA(致癌物质亚硝基二甲胺)引发的“毒素门”事件。
什么是基因毒性杂质
基因毒性杂质的定义主要是指:
基因毒性杂质是一类可与DNA反应,造成DNA损伤,在很低水平下即可诱发基因突变,并可能致癌的杂质。主要有PGIs(potentially genotoxic impurities 潜在基因毒性的杂质)与GIs( genotoxic impurities 基因毒性杂质)
其危害如下:
按照目前的法规来说,(体内) 基因毒性物质在任何摄入量水平上对DNA都有潜在的破坏性,这种破坏可能导致肿瘤的产生。因此,对于基因毒性致癌物,不能说“不存在明显的阀值,或是任何的摄入水平都具有致癌的风险”。
基因毒性杂质的控制
基因毒性杂质的控制是药品质量关注的ZD!对业界和监管部门也是一个巨大的挑战。
基因毒性杂质的警示结构
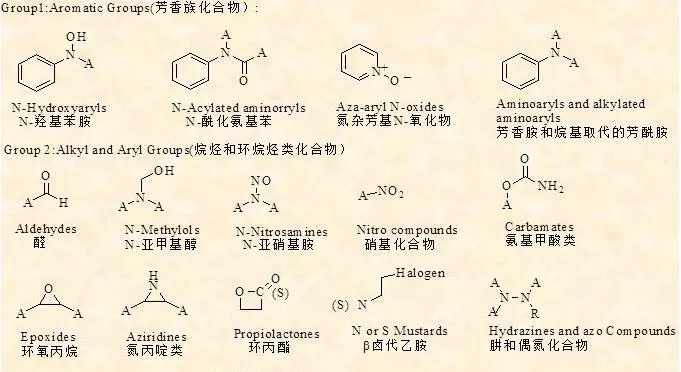
注:基因毒性的警示结构不只限于以上所列,了解更多可参见:马磊,马玉楠等.遗传毒性杂质的警示结构 .ZG新药杂志 ,2014,23(18) :2106~11
原料药及制剂杂质评估
1、 合成工艺杂质:
① 起始物料、中间体中检出的杂质;(杂质谱分析!)
② 从起始物料至成品整个路线中可能的反应副产物;(杂质谱分析!)
③ 长路线早期的部分杂质或许可以忽略;(反应步骤!)
④ 基于风险角度提供依据说明工艺路线中哪个节点后的杂质应作致突变性评价;(反应步骤!)
⑤ 工艺后期步骤使用的起始物料,应对该起始物料ZH一步合成涉及的基因毒性杂质进行评估。(反应步骤!)
2、 降解杂质:
① 实际检出杂质:长期稳定性及制剂过程中检出的报告限度以上杂质(ICH Q3A/B );
② 潜在杂质:加速试验及光照试验检出的鉴定限以上杂质,长期未确认。
CATO基因毒性杂质标准品
助力仿制药一致性评价工作
药品中的杂质包括有机杂质、无机杂质和残留溶剂,而遗传毒性杂质不同于药品中的一般杂质,有着重大的安全风险,极微量水平即能诱发DNA 突变。因此控制药品中遗传毒性杂质是保障药品质量和安全的ZD。
针对NDMA这一类基因毒性杂质的检测,CATO分析标准品推出基因毒性杂质标准品系列,助力药企的研发试验工作。

※了解更多相关基因毒性杂质标准品及产品详细信息请联系CATOZG区du家代理商(药物杂质标准品系列产品)——广州优瓦科技有限公司,4000-868-328,或者浏览我们的网站ch.cato-chem.com进行查询。

 评论
评论