许多包膜病毒诸如人类免疫缺陷病毒(即艾滋病毒,HIV),埃博拉病毒、流行性感冒病毒(IFV)和冠状肺炎病毒等致命性病毒对人类健康和公共卫生构成了持续的威胁。因此,关于病毒开展的各方面研究备受关注。其中,包膜病毒的细胞膜渗透行为是病毒进入宿主细胞,感染宿主细胞等一系列事件中的关键步骤。在病毒进入宿主细胞的过程中,包膜病毒如何与宿主细胞受体相互作用以及病毒膜包膜自身如何经历结构变化,Z终进入宿主细胞的病毒-细胞膜渗透行为的研究,能为开发新型抗病毒疗法和疫苗提供有利信息。
近年来,流感病毒(IFV, 结构示意图1)已被用作包膜病毒的原型来研究病毒进入宿主细胞的过程。IFV中血凝素(HA)是嵌入IFV包膜的主要表面糖蛋白。 HA负责IFV与宿主细胞受体的连接,并在病毒进入过程中参与介导膜融合。众多研究已经为靶标和病毒膜之间的融合机制建立了一个公认的模型。该模型认为只有在靶标和病毒膜发生膜融合时才可形成孔从而介导病毒-细胞膜渗透行为。然而,其他报道也观察到在融合发生之前靶标和病毒膜的破裂。此外,关于腺病毒蛋白与宿主细胞的研究显示,宿主细胞膜可能在没有膜融合的情况下被破坏而进入病毒。另一方面,病毒包膜和靶宿主细胞膜具有不同的化学组成或结构,各个膜中形成孔的要求不同,因此靶宿主或病毒膜破裂也可能独立地被诱导。
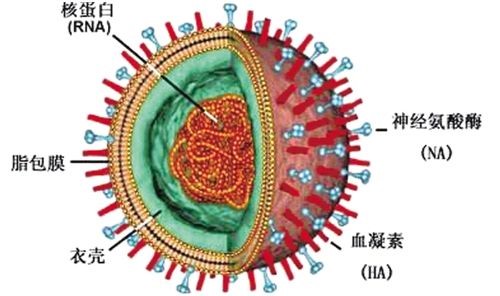
图1 流感病毒示意图 (百度百科)
综上所述,关于病毒-细胞膜渗透行为的机理还存在一定的争议,明确单个病毒与宿主细胞的复杂融合机制,可为设计抗病毒化合物提供有利信息。然而,常规的病毒整体融合测定法是对膜融合事件的集体响应,不能对细微、尤其是在纳米尺度复杂的融合细节进行直接和定量的研究,因此无法直接量化一些可以通过研究单个病毒、纳米尺度表面糖蛋白和脂包膜来获得的融合细节。例如,病毒感染过程在分子水平上引起的病毒膜和宿主细胞膜的化学和结构组成改变,可以通过分子特异性红外光谱技术来探测。然而,单个病毒、表面糖蛋白和脂包膜尺寸小于红外光的衍射极限,限制了单个病毒的红外光谱研究。因此,找到一个既可以提供纳米高空间分辨率,还能探测机械、化学特性(分子特异红外光谱)和环境影响的工具,使其可在单病毒水平上研究病毒膜融合过程是十分重要的。
德国neaspec公司经多年研发的纳米分辨傅里叶红外光谱和成像系统(nano-FTIR & neaSNOM)采用ZL化的散射式核心设计和准外差技术以及独特的宽光谱高能激光器(光谱范围:650—4000 cm-1),基于传统傅里叶红外光谱的核心原理,使得光谱和成像信息直接源于光学信号,无需光-热、光-力等复杂信号的转换,能对空间分辨率低至10 nm的样品进行直接的红外光谱及成像测量,提供与传统傅里叶光谱完全一致的红外光谱测量结果。因此,德国neaspec公司的纳米分辨傅里叶红外光谱与成像系统可实现高分辨率单个病毒、表面糖蛋白和脂包膜的原位光谱、化学图谱和结构鉴定,以及病毒与环境触发因素和细胞的相互作用研究,是单病毒水平上研究病毒膜融合过程的wan美工具。

图2 德国neaspec公司纳米分辨傅里叶红外光谱与成像系统( nano-FTIR & neaSNOM)实物图
来自美国乔治亚大学和乔治亚州立大学的Sampath Gamage和Yohannes Abate等研究者采用 nano-FTIR & neaSNOM研究了单个原型包膜流感病毒X31在不同pH值环境中发生的结构变化。同时,还定量评估了在环境pH值变化期间,抗病毒化合物(化合物136)阻止病毒膜破坏的有效性,提供了一种YZ病毒进入细胞的新机制。
nano-FTIR和neaSNOM对流感病毒 X31的近场红外光谱及成像研究提供了高空间分辨的优异光谱和成像结果,具体结果如下:
能清楚观察到单个流感病毒的形貌(高度20-30 nm, 大小约70-100 nm);
不同红外波长下病毒红外吸收对比明显;
HA富集在病毒包膜外(对比图3 中f和g:包膜外1088 cm-1无红外吸收信号,1659 cm-1 有红外吸收信号,蛋白质在1659 cm-1 有吸收而在1088 cm-1没有);
nano-FTIR 能获取到病毒蛋白红外光谱(1500-1750 cm-1范围 Amide I 和Amide II 峰);
nano-FTIR 能获取到病毒的脂类、磷酸盐和RNA的红外光谱(1290-1050 cm-1范围)。
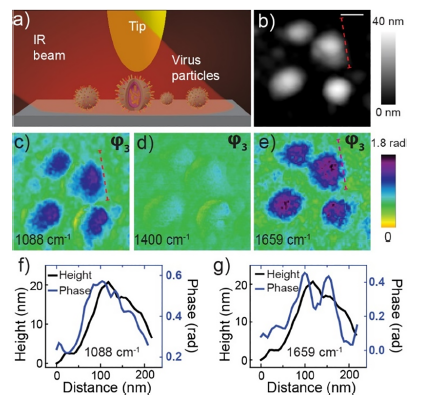
图3 流感病毒的neaSNOM近场光学红外成像 (pH 7.4) a):实验示意图;b):病毒形貌成像(标尺 100 nm);c-e):不同红外波长下近场光学相位成像(红外吸收);f) 和 g):b,c)和 b, e)红色虚线相应的截面分析
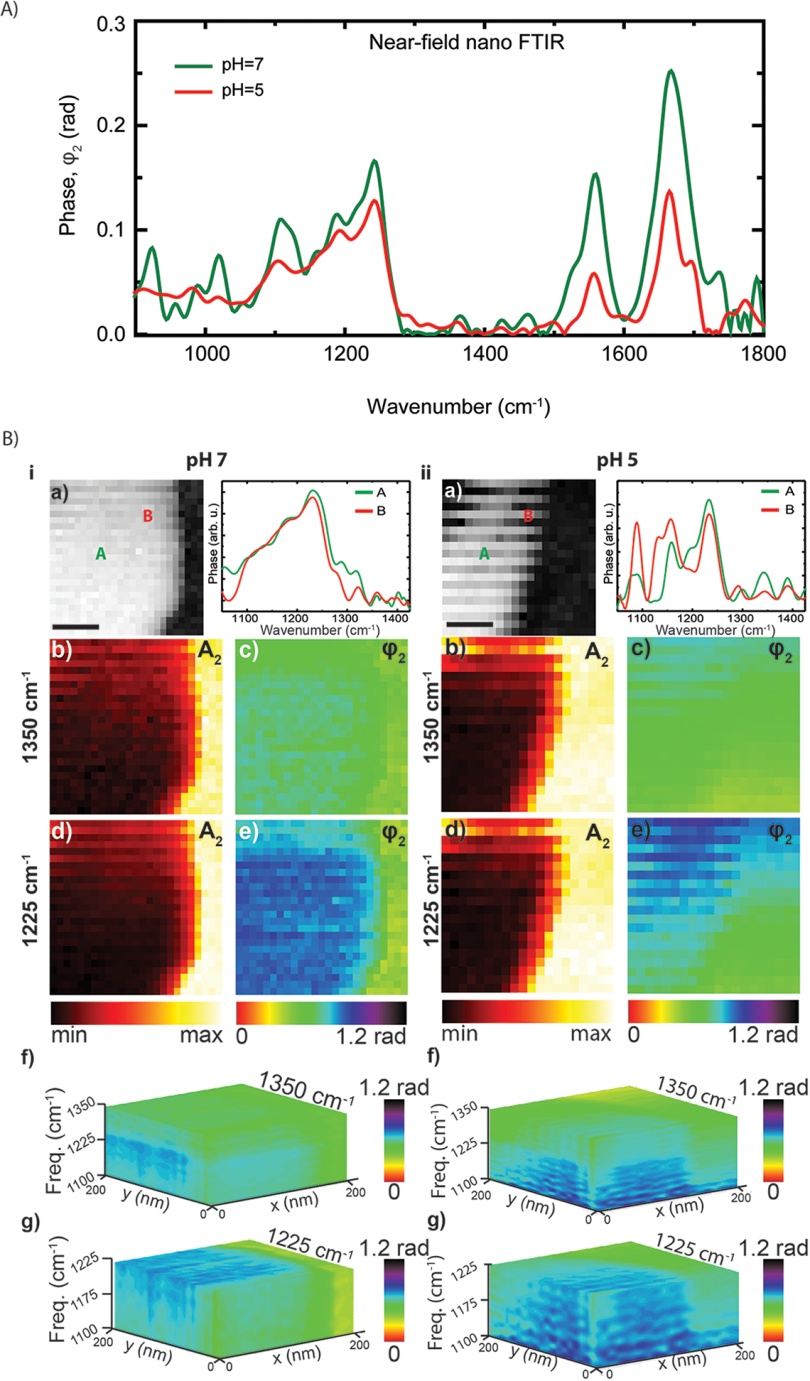
图4 流感病毒的nano-FTIR光谱及高光谱成像(pH 7.4)A):nano-FTIR红外吸收光谱(pH 7和pH 5); B):病毒形貌及高光谱成像(标尺 100 nm)
综上所述,在该研究工作中,作者对单个流感病毒颗粒进行了光谱和成像实验,研究了各种pH值变化环境中以及与抗病毒化合物相互作用时病毒蛋白和脂质双层的化学和结构变化。结果表明在不存在靶细胞膜的情况下,降低pH环境依然会造成病毒包膜破裂,这与当前的病毒融合模型相反。此外,融合YZ剂化合物136可以有效阻止低pH环境引起的病毒包膜破坏。除流感病毒外,德国neaspec公司提供的nano-FTIR和neaSNOM技术同样可能适用于其他包膜病毒(例如,HIV、冠状肺炎病毒等)的研究,并能为基础病毒学研究提供新思路。
参考文献:
[1]Sampath Gamage, Yohannes Abate et al., Probing structural changes in single enveloped virus particles using nano-infrared spectroscopic imaging, PLOS ONE https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0199112

 评论
评论