肿瘤ZL已有250多年的历史。自传统的化疗起,肿瘤ZL经历了传统化疗/放疗时代,基于小分子和抗体的靶向药时代,肿瘤免疫ZL时代,和当下的jing准YL时代。与此同时,珀金埃尔默一直致力于——“为了更健康的世界,不断创新”,从传统化疗/放疗-基因组学-高通量筛选-单细胞组学-生物制药多个方向全面助力肿瘤ZL创新之路。在此,我们盘点肿瘤ZL历史的大事件,并从应用角度介绍珀金埃尔默对肿瘤ZL的贡献。

传统ZL
传统ZL兴起于90年代,主要包括手术切割,放射疗法和化学ZL等。通过近三十年的努力,美国于1937年建立National Cancer Institute (NCI) 用于开展肿瘤研究,深入了解肿瘤发病原因并开发有效的ZL方案。同年, Richard Perkin 和 Charles Elmer 合伙创建珀金埃尔默(PerkinElmer)并涉足分析仪器领域,推出原子吸收光谱仪用于追踪顺铂类化疗药物的摄取。PerkinElmer 于1987年推出shou个商业化PCR系统Perkin-Elmer Cetus DNA Thermal Cycler,助力分子克隆研究。尽管近年来新的疗法不断涌现,传统疗法依然是当下肿瘤ZL的中流砥柱和一线手段。基于传统疗法,我们致力于耐药研究和联合用药等方向的前沿应用,如单细胞ICP-MS联合高内涵在单细胞组学水平研究肿瘤耐药机制[1],基于Alpha技术的高通量筛选则为靶向耐药的联合用药ZL方案打下基础(下图)[2]。
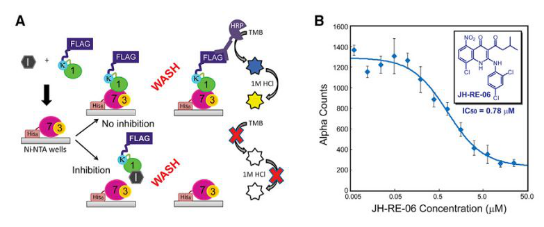
图片源自文献:
Cell. 2019 Jun 27;178(1):152-159.e11.
靶向ZL
上个世纪80-90年代的分子研究,包括针对癌症相关基因如P53和HER2基因的鉴定和克隆,为靶向药物开发打下了基础。1997年罗氏Roche药厂研发靶向CD20的利妥昔单抗(Rituximab)成为shou个获批的单克隆抗体。次年的曲妥珠单抗(Trastuzumab)在美国获批,用于 HER-2阳性乳腺癌ZL。曲妥珠单抗的获批显著提升治LX果的同时,也极大的推动针对乳腺癌的靶向ZL开发。2001年FDA批准shou个激酶YZ剂格列卫(Imatinib mesylate),标志着肿瘤ZL进入靶向ZL时代。针对含有费城染色体融合基因 (BCR-ABL)的慢性骨 髓性白血病病人,格列卫ZL可达到惊人的90%反应率,并能做到对疾病的持久控制。2001年也同时见证了shou个Magic bullet抗体药物偶联物(Antibody Drug Conjugates ,ADCs)的获批。与后期兴起的免疫ZL不同,ADCs在病人免疫系统受损的情况下依然能发挥效果。
随着格列卫的获批,多种的小分子靶向药物,尤其是激酶YZ剂进入市场[3]。同时,珀金埃尔默的小动物产品线也发挥活体成像的优势,助力多个小分子药物获批,其中包括由舒尼替尼(Sunitinib)和尼罗替尼(Nilotinib)。除了激酶YZ剂外,珀金埃尔默的活体成像平台也参与了shou个,也是目前唯yi获批的蛋白酶体YZ剂硼替佐米(Bortezomib)的研发。
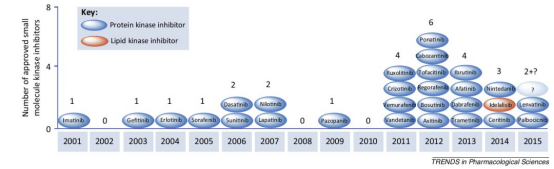
图片源自文献:
Trends Pharmacol Sci. 2015 Jul;36(7):422-39.
针对靶向ZL,珀金埃尔默参与了多个领域的进展。在基因水平研究,GeneAmp Thermo Cycler和ABI PRISM 310 Genetic Analyzer可用于分析描述BCR-ABL[4]。在激酶YZ剂研究领域,1998年我们推出了均相免疫检测LANCE平台,并进一步在2006年推出LANCE Ultra 平台,专注体外激酶活性筛选,除了分子水平外,我们的激酶解决方案还涵盖了细胞和活体水平研究,例如新一代TRKYZ剂研究的案例[5]。同时,我们一直致力于高通量药物筛选及药物研发应用,推出行业金标准多模式读板仪Envision和高内涵成像分析平台Opera 和Operetta,以及对应的试剂耗材和移液工作站平台,并在今年收购拥有HTRF®免疫检测技术的生命科学领域企业Cisbio Bioassays,以加速药物筛选、靶向药物发现和联合用药研究[6]。
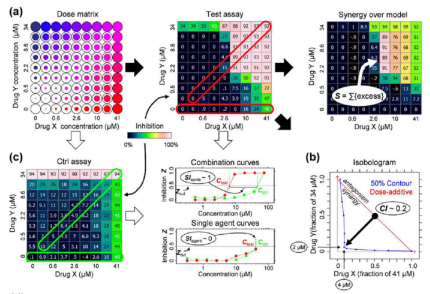
图片源自文献:
Nat Biotechnol. 2009 Jul;27(7):659-66.
肿瘤免疫
新兴的肿瘤免疫主要包括两个大板块:以免疫检查点YZ剂为代表的肿瘤免疫ZL和以CAR-T疗法为代表的免疫细胞ZL。除此之外,免疫疗法还包括个性化肿瘤疫苗,溶瘤病毒和改造抗体例如BITE等。
在肿瘤免疫ZL领域,靶向细胞毒性T细胞抗原-4(CTLA-4)的伊匹单抗(Ipilimumab,Yervoy)成为shou个获批的免疫检查点YZ剂,并开启了肿瘤免疫时代。2014年同时见证了两款靶向PD-1的肿瘤免疫ZL明星药:帕博利珠单抗(Pembrolizumab, Keytruda,K药)和欧狄沃(Nivolumab, Opdivo,O药)的成功上市。值得一提的是,珀金埃尔默的DELFIA平台参与了O药的体外研发过程中的ADCC检测[7]。肿瘤领域免疫ZL带来的里程碑式的突破也让两位先驱 James P. Allison 和Tasuku Honjo,摘得2018年诺贝尔生理学或医学奖桂冠。在他们的研究成果中,不乏看到珀金埃尔默的身影。例如,我们的核酸解决方案协助Tasuku Honjo研究PD-1激活机制[8]。在解析肿瘤免疫微环境的研究过程中,James P. Allison作为MD Anderson癌症ZX的一线科学家,多次使用多光谱组织病理成像系统进行肿瘤免疫微环境全景分析[9-10]。

图片源自文献:
Nat Rev Drug Discov. 2018 Dec;17(12):922.
在细胞ZL领域,2017年由诺华推出的shou个CAR-T细胞疗法Kymriah™ 的获批上市无疑是一针强心剂,激励肿瘤ZL方向细胞疗法的研发投入。当下,在肿瘤ZL领域,细胞ZL增长Z为迅猛,成为Z火热的研发管线[11]。靶向包括CAR-T和CAR-NK在内的细胞ZL,我们同样提供多个维度的金标准解决方案,主要包括体外水平的细胞功能评价[12]和体内水平研究[13]。在细胞功能描述上,我们支持细胞因子检测、细胞增殖追踪和基于高内涵以及多模式检测平台细胞杀伤效力评价。在体内水平研究,强大的IVIS活体成像平台则可协助监测体内肿瘤进展以及追踪免疫细胞体内的分布和迁移[14]。进一步在组织水平,多光谱组织病理成像系统则可通过其多标和成像优势深入解析细胞ZL对肿瘤免疫微环境带来的变化[15]。
jing准YL
肿瘤ZL的变革的背后也贯穿着jing准YL的演化。jing准YL(Precision Medicine)于2011年首次被定义,并因2015年jing准YL计划(Precision Medicine Initiative)的宣布成为覆盖的热门话题。在2016年的美国国家癌症射月计划(Cancer Moonshot)中再次强调利用jing准YL进行药效预测。同年ZG也正式启动jing准YL计划,并将其列为国家重大战略性新兴产业。
图片源自文献:
Comprehensive Medicinal Chemistry III 2017, Pages 388-415
虽然从定义上来看jing准YL不依赖于某个特定的技术平台,但测序技术,尤其是二代测序的兴起对jing准YL的推动不言而喻。在测序技术的引ling下,我们已从基因测序时代步入大数据时代。然而,现阶段肿瘤ZL依然难以复制格列卫的临床效果。肿瘤细胞的高度异质性和持续进化能力让基于终点法的测序技术很难有效的预测肿瘤细胞-药物相互作用。与此同时,免疫ZL的成功更是向我们强调了细胞间相互作用的重要性。为了克服这些挑战,并将jing准YL推向新的高度,珀金埃尔默主要致力于两个方向开发应用:(1)基于ICP-MS和高内涵等平台的单细胞组学研究和(2)以新兴类器官和病人来源原代细胞为基石的个性化指导用药研发[16-18]。类器官结合了表型筛选和3D水平研究于一体,Z大程度提高生理/病理相关性的同时支持中高通量的筛选,为jing准用药,肿瘤基因型-药物相互作用研究和样品库制备开辟了新的道路[19]。

会议邀请
会议时间:
2019年7月24日
会议地点:
恒盛酒店二楼恒盛厅(昆明市龙泉路77号)
欲了解更多大会咨询,请复制下面链接进行查看
http://www.kiz.ac.cn/qt/tzgg/sygg/201906/t20190625_5328203.html
参考文献
[1]单细胞ICP-MS联合HCS为您揭秘顺铂化疗耐药机制
https://mp.weixin.qq.com/s/foZlyjWWXddY5FK0woqy2A
[2] Wojtaszek JL, et al. A Small Molecule Targeting Mutagenic Translesion Synthesis Improves Chemotherapy. Cell. 2019 Jun 27;178(1):152-159.e11.
[3] Wu P, et al. FDA-approved small-molecule kinase inhibitors. Trends Pharmacol Sci. 2015 Jul;36(7):422-39.
[4] Chasseriau J, et al. Characterization of the Different BCR-ABL Transcripts with a Single Multiplex RT-PCR. J Mol Diagn. 2004 Nov;6(4):343-7.
[5] jing准YL案例速递 | TRKYZ剂拉罗替尼开启泛癌种ZL新篇章
https://mp.weixin.qq.com/s/-ZjWrUBnj2nqOG6hXBhRuQ
[6] Lehár J, et al. Synergistic drug combinations improve therapeutic selectivity. Nat Biotechnol. 2009 Jul;27(7):659-66.
[7] Wang C, et al. In Vitro Characterization of the Anti-PD-1 Antibody Nivolumab, BMS-936558, and In Vivo Toxicology in Non-Human Primates. Cancer Immunol Res. 2014 Sep;2(9):846-56.
[8] Freeman GJ, et al. Engagement of the PD-1 Immunoinhibitory Receptor by a Novel B7 Family Member Leads to Negative Regulation of Lymphocyte Activation. J Exp Med. 2000 Oct 2;192(7):1027-34.
[9] 2018诺贝尔奖得主James P. Allison桂冠之下的荆棘与赤诚
https://mp.weixin.qq.com/s/s773rk2aWrmVP0r5TpUg-Q
[10] Jianjun Gao, et al. VISTA is an inhibitory immune checkpoint that is increased after ipilimumab therapy in patients with prostate cancer. Nat Med. 2017 May; 23(5): 551–555.[11] Tang J, et al.Trends in the global immuno-oncology landscape. Nat Rev Drug Discov. 2018 Dec;17(12):922.
[12] 细胞ZL干货 | 免疫细胞杀伤经典案例
https://mp.weixin.qq.com/s/47krDPy-vsxSP91T1GDw
[13] IVIS视角——回顾2018年Carl H. June教授团队在CAR T领域的相关研究成果
https://mp.weixin.qq.com/s/NMukfK6zcG8foSc7l4q6_w
[14] Smith EL, et al.GPRC5D is a target for the immunotherapy of multiple myeloma with rationally designed CAR T cells.Sci Transl Med. 2019 Mar 27;11(485).
[15] Ng SSM, et al.Heterodimeric IL15 Treatment Enhances Tumor Infiltration, Persistence, and Effector Functions of Adoptively Transferred Tumor-specific T Cells in the Absence of Lymphodepletion. Clin Cancer Res. 2017 Jun 1;23(11):2817-2830.
[16] Snijder B, et al.Image-based ex-vivo drug screening for patients with aggressive haematological malignancies: interim results from a single-arm, open-label, pilot study. Lancet Haematol. 2017 Dec;4(12):e595-e606.
[17] Lee JK, et al.Pharmacogenomic landscape of patient-derived tumor cells informs precision oncology therapy. Nat Genet. 2018 Oct;50(10):1399-1411.
[18] Vlachogiannis G, et al.Patient-derived organoids model treatment response of metastatic gastrointestinal cancers.Science. 2018 Feb 23;359(6378):920-926.
[19] L.Li, et al.P 3D High-Content Screening of Organoids for Drug Discovery. Comprehensive Medicinal Chemistry III 2017, Pages 388-415
关于珀金埃尔默:
珀金埃尔默致力于为创建更健康的世界而持续创新。我们为诊断、生命科学、食品及应用市场推出独特的解决方案,助力科学家、研究人员和临床医生解决Z棘手的科学和YL难题。凭借深厚的市场了解和技术专长,我们助力客户更早地获得更准确的洞见。在,我们拥有12500名专业技术人员,服务于150多个国家,时刻专注于帮助客户打造更健康的家庭,改善人类生活质量。2018年,珀金埃尔默年营收达到约28亿美元,为标准普尔500指数中的一员,纽交所上市代号1-877-PKI-NYSE。
了解更多有关珀金埃尔默的信息,请访问www.perkinelmer.com.cn
 邀请函|复旦大学医学院-珀金埃尔默共建示范实验室开放日活动
邀请函|复旦大学医学院-珀金埃尔默共建示范实验室开放日活动
 画一画就能拿iPad?珀金埃尔默邀请您参加ChemDraw化学绘图大赛!
画一画就能拿iPad?珀金埃尔默邀请您参加ChemDraw化学绘图大赛!
 邀请函|珀金埃尔默邀请您参加2019ZG药品检验技术大会
邀请函|珀金埃尔默邀请您参加2019ZG药品检验技术大会

 评论
评论