介绍
微塑料正成为一个重大的环境问题。定期、有新闻价值的重大研究揭示,塑料和微塑料存在于偏远的地理位置,或作为污染物存在于不同消费品(特别是食品和饮料)中以及海洋生物消化系统内。微塑料的来源可能是初生微塑料,即专门设计或制造成小尺寸的材料,或者从较大材料开始但在环境中分解成较小碎片的次生微塑料。Z初,微塑料经定义为尺寸小于5 mm的塑料材料,但是,尽管尚未有公认的定义,但该定义现在经更普遍地表述为尺寸处于1 mm且小至微米水平范围内的塑料颗粒。
环境中大量的塑料污染是一个看得见的重大问题,亟待解决。小尺寸的微塑料人眼并不能看到,但它对水生和海洋物种的健康有着重要影响,并且Z终可能会进入人类食物链。
分析含有微塑料的环境样品对确定其普遍性及其影响至关重要。一系列的分析技术已应用于微塑料的分析。在所采用的技术中,红外(IR)光谱分析,更具体而言是红外显微镜,是检测和鉴别微塑料的主要分析技术。
红外显微镜的微塑料分析操作流程
从原始样品到Z终结果有几个步骤,包括采集样品到数据分析。所涉及的步骤可能会有所不同,这取决于样品类型和红外(IR)分析制备样品所需的样品净化量。工作流程如表1
所示。
表1.微塑料分析操作流程所涉及的步骤。
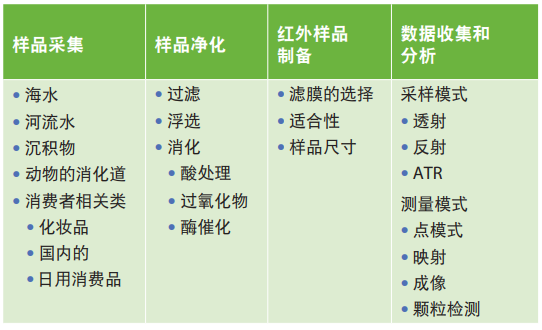
不同来源的样品和不同类型的样品都需要对其微塑料的含量进行分析。不同的样品在采集和净化方面均有其自身的复杂性。例如,瓶装水中微塑料的分析无需对样品净化,而只需进行简单的过滤即可分析。而污水或动物摄入的微塑料则需花费几天时间去净化样品,消解其他有机材料,从而对微塑料进行“洁净”分析。
样品采集
以下对不同来源的样品所采取的采样策略做简要概述。
水采样
小溪、河流到湖泊、远海等多种不同水环境含有微塑料。此外,据悉来自水处理厂的水也含有微塑料。采样要求之间存在相似之处,因为要采集所需粒径范围内的所有微塑料,并且了解水样的体积也非常重要。采用一致的采样策略,可确定微塑料的数量和/或质量随着时间的推移呈增加还是减少趋势。
样品采集对海水和淡水具有不同的要求,这主要是因为水密度不同。大多数合成高分子材料的密度低于海水,这意味着微塑料一般漂浮在水面上,但是许多高分子类型材料都会沉没在淡水系统中。用于采集海水表面样品的典型设备是一个拖于船后的已知网目尺寸的曼塔拖网。对于水层面下的样品,则采用合适的浮游生物采集网。这种方法也适用于湖泊和水湾。网目尺寸是一个重要的参数,因为太小的网目会导致网在样品采集过程中受到相当快的阻塞。样品采集的体积和面积可通过使用流量计以及根据网的入口尺寸和采集过程中移动的距离得以确定。为测试河流水,通常将网悬挂于河流中的一个固定点,并且网的位置可得到设置或调整,以便在水面上或水面下的固定深度进行采集。
沉积物采样
在许多情况下,可在沉积物样品(例如在海滩或河岸上)的表面上观察到(微)塑料。在这种情况下,在分析前可易于对样品进行提取和清理。但是,微塑料存在于沉积物的更深层处,因此需要采用一种采样策略。通常采集已知质量或体积的沉积物,并确定每单位体积颗粒的质量或数量。沉积物样品可采集自海床、湖泊或河床,或者在潮汐或河流水位降低时采集自海滩或河岸。沉积物样品需要进一步的样品净化以便提取微塑料用于分析,下文将对该过程做介绍。
动物摄入的塑料采样
据悉,塑料和微塑料存在于多种海鸟和海洋生物的胃中,且通常会导致死亡。1较大的塑料材料可从生物的解剖胃中物理提取而得,其在分析前需进行清理。为确定包括微塑料在内的塑料总量,有必要在分析前通过消解完全去除生物材料。下文将对消解的各种方法作讨论。消解过程会留下塑料材料并且有望去除所有其他材料。
家用品和日用消费品采样
在家庭中有几种微塑料被释放到排水系统中。众所周知,洗衣机在清洗的过程中会产生成千上万的纤维。2此外,尽管根据不同国家和地区的立法,塑料微珠的使用正在逐步淘汰,但是许多日用消费品和化妆品(例如牙膏和沐浴露)均含有塑料微珠成分。来自家用品的微塑料的采样可通过在洗衣机的出水口或排水系统的出水口上安装具有合适网目尺寸的筛网得以完成。就去角质剂和身体磨砂膏而言,其大多数成分具有水溶性,因此在过滤前,将样品与开水混合通常能去除微塑料之外的所有物质。3
样品净化
为从红外显微镜分析中获得Z佳结果,必须确保样品洁净且无任何干扰物质(例如生物基质)。以下是红外分析前用于样品净化所采用的不同方法的简要概述。
密度分离法(漂浮)
塑料具有多种密度范围,因此一些塑料会漂浮在淡水或海水中,而另一些则会沉没。这种漂浮原理可用于将塑料材料与密度通常较高的其他物质(例如沉积物)分离。通过将样品与(密度较高的)饱和盐溶液混合,可扩大漂浮的塑料材料的范围,并且可从液体的上层部分去除塑料。
塑料的密度范围大约从0.9g/cm3(聚丙烯(PP)和低密度聚乙烯(LDPE))至1.4g/ cm3(聚对苯二甲酸乙二醇酯(PET)和聚氯乙烯(PVC))不等。4
因此对于典型密度为1-1.05g/cm3的淡水或海水样品,PP和LDPE将通过漂浮从密度显著较高的沙子或沉积物中分离出来。
已采用一系列将溶液密度Z大化的饱和盐溶液,以便使更多种范围的塑料材料得以漂浮。5,6,7采用了密度为1.2-1.8g/cm3的氯化钠、溴化物和碘化物以及密度为1.7g/cm3的氯化锌。分离过程包括搅拌样品,通常是沉淀物样品,并使溶液沉降。然后取溶液的上清液过滤后分析。
样品消解
样品消解的目的是去除会干扰微塑料分析但不会影响微塑料本身的生物、无机或有机材料。根据样品基质,可采用一系列不同的样品消解技术。用于消解的材料可具有酸性、碱性、氧化性或酶促性。8,9,10对于酸性消解,采用的是热硝酸,但是这将导致一些高分子类型材料降解。10%的氢氧化钾溶液已作为基底物。经证明,处于30-40%范围内的过氧化氢溶液具有有效性。但是,消解可能较缓慢,其需要耗费几天时间才可完成。采用蛋白酶K作为酶消解具有有效性。这种处理速度显著加快,并且在50℃下两小时的消解可从样品中去除大量生物材料并且不会降解塑料本身。
过滤
在一些样品类型中,过滤是指从样品基质中分离出所需的微塑料(例如瓶装水中微塑料的采集和测量)。在许多情况下,过滤是样品净化过程后的附加步骤。过滤过程需要符合分析的要求,并且可用作样品净化步骤。使用不同网目尺寸的筛网可以将塑料收集调整到分析技术所需的样品尺寸大小。例如,Z初采用大的网目尺寸可过滤掉存在的较大塑料或者可去除其他较大的碎片,以便防止过滤器堵塞。微塑料可受到较小网目尺寸的筛网或滤膜的截留。采用标准红外光谱仪易于分析较大的塑料。但是,红外显微镜更常用于微塑料的分析。在某些情况下,对筛网上采集的微塑料所作的红外显微镜分析可直接在筛网上进行。3过滤过程的优化将在后面进行描述。
用于红外分析的样品制备
红外光谱分析是识别和鉴定高分子材料的主要分析技术。材料的红外光谱为该材料提供唯yi的“指纹”,并且可与大量的光谱库作比较以进行正确识别。采用标准的红外光谱仪器和衰减全反射(ATR)采样技术易于测量尺寸不小于100微米左右的微塑料纤维和颗粒。小型便携式红外光谱仪器(图1)可携带至船上,以便立即识别采集的样品。11
对于利用ATR进行测量的较大样品,通常无需样品制备。将样品直接置于ATR附件上,采用压力臂施加压力并扫描样品。但是,应注意的是,在环境中存在了相当长时间的塑料已风化,并且其表面可能覆有生物膜。ATR是一种表面技术。因此,在这种情况下,建议将塑料样品切片并测量样品的内部体积而非受损/受包覆表面。
红外显微镜或红外成像系统可用于测量更小的颗粒。为从此类技术中获得Z佳结果,必须将微塑料从样品基质中分离出来。上述样品采集和样品净化的介绍中已对该方法作出讨论。但是,具体操作步骤可针对红外显微镜进行优化。

图1.具有ATR采样模块的Spectrum Two红外光谱仪。
优化红外显微镜分析的过滤过程
样品过滤会将微塑料分离至合适的基底上用于分析。滤膜具有多种尺寸、过滤材质和孔径尺寸,以便优化过滤过程。某些过滤材料在光谱的红外线区域内具有显著的吸附作用,并且这些材料将掩盖因感兴趣的颗粒引起的吸附。因此,采用Z合适的过滤材料极其重要。一系列不同的滤膜类型和尺寸已得以评价,以便为红外显微镜的微塑料分析确定Z佳滤膜类型(表2)。
表2.评估一系列不同的滤膜与显微红外测试的适用性
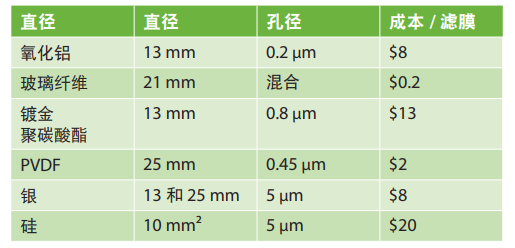
滤膜直径将影响样品容量和过滤能力并且应保持具有合理的尺寸,以便减少红外成像所需的时间。孔径将决定待截留的Z小粒径,但该尺寸不能易受某些样品基质堵塞。对于与红外分析之间的兼容性,(归因于红外分析的近似衍射极限)颗粒需大于1.5微米,并且滤膜的可用光谱范围极其重要。每个滤膜的相对成本可能非常重要,但是对于样品净化可能耗费几小时或几天时间的样品,滤膜的成本就并非十分重要。对于样品处理量较高的实验室,这应该是一个重要的考虑因素。
下文将对红外显微镜的采样模式作更详细的讨论,但是对于滤膜上的颗粒分析,其选择通常受限于透射或反射。在进行多种颗粒的自动测量时可使用ATR,但是样品容易受到交叉污染。滤膜类型需要在透射或反射模式下对红外光不出现任何显著的吸收。表1所示是记录了滤膜的红外透射和反射光谱,并确定每种类型的可用范围。图2a所示为透射模式总结,而图2b所示为反射模式总结。
镀金聚碳酸酯滤膜具有极好的反射能量,但无透射能量,而PVDF滤膜在透射和反射模式下均显示出显著的吸收带,因此不合适。
建议使用硅滤膜进行透射分析,并使用硅、银膜或镀金聚碳酸酯进行反射分析。
硅的唯yi缺点是相对成本较高以及不是标准过滤系统所直接兼容的尺寸,属于“非标准”尺寸(矩形尺寸)。
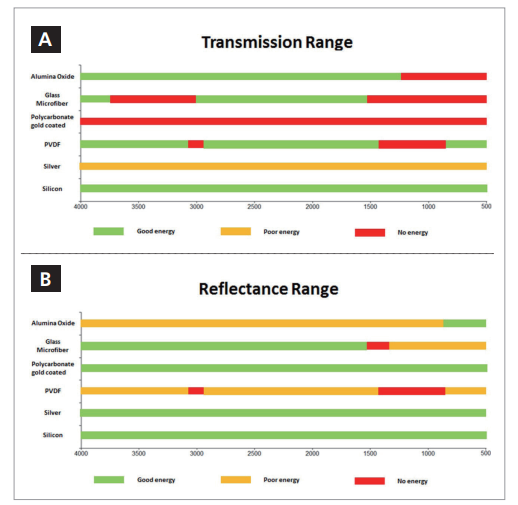
图2a和2b。不同滤膜类型的透射和反射范围。
两种不同滤膜类型的示例光谱如图3所示。

图3.不同类型滤膜的透射和反射范围。
显微红外分析
 、
、
图4.PerkinElmer Spotlight 400红外成像系统
采样模式
采用红外测量常规样品的原则,使用显微红外对微塑料样品进行测量。采样模式是透射、反射或ATR。相同的优势和不足之处同样适用于显微红外。
1.透射
为在透射模式下测量样品,样品应置于合适的红外透射基底上。样品厚度通常应小于50微米,以免达到吸收饱和。如果分析包含少量颗粒,且可能“挑选”颗粒,则Z好的方法是将颗粒定位于显微镜样品载物架的13mm KBr窗片上。如此可确保分离颗粒,并将采集到颗粒的纯光谱。如果颗粒厚度大于50微米,则可将样品置于微型金刚石压池中,压至更薄的尺寸,可以在显微镜台上进行透射测量。但是,在大多数情况下,即使使用显微镜工具,样品也显得太厚或不容易分离。如前所述,可使用合适的红外透射模式的滤膜,而无需制备样品或将颗粒移除至其他基底上。另外,在大多数情况下,某些颗粒的尺寸小于50微米,而另一些则更大。去除大量颗粒的过程耗时长且困难。
2.反射
当分析目的是定性样品时,通常不在本体聚合物上进行反射测量(直接镜面反射法)。所获得的光谱将包含混合的光谱成分,即表面反射和透射/反射成分。此类成分会导致光谱失真,特别是光谱的较强波段,并会干扰光谱库的搜索过程。但是,透射/反射成分通常可能是主要的光谱贡献,并产生可识别的光谱。当红外光束照射到样品时,一些光束将直接反射离开样品表面,其余光束将进入(透射)或穿过样品。如果将样品置于高反射基底上,如金反射镜或反射滤膜,则光束将反射离开该基底并回穿样品,从而有效地提供双重透射。因此,从反射测量中可获得优质的光谱,但是,Z强波段可能非常强。对于有一定厚度的样品,反射比透射效果好。
3. ATR
ATR已成为在FT-IR仪器上简单测量和识别样品的标准技术。该技术无需制备样品,并且可作用于一系列不同的样品尺寸,包括在透射或反射方面不起作用的厚度过大的样品。这是一种表面测试技术,因此,所获得的光谱是材料表面的光谱,而非体积光谱。此外,所测量的有效样品厚度处于1或2微米的范围内,这导致红外光谱较弱。但是,所获得的光谱强度足以识别材料或材料的主要成分。显微红外可配备微型ATR晶体,以对微粒进行自动ATR测量。如果样品位于坚硬的固体基底上,如金反射镜、窗口材料或显微镜载玻片,并且含有非常少量的颗粒,则在每次测量/颗粒之后,只要清洁ATR晶体,ATR即可成为一种可使用的技术。ATR的测试原则是基底与ATR晶体之间的对样品的压缩。在测量之后即释放压力时,样品经常留在ATR晶体上,而并非回到基底上。因此,如果在不清洁晶体的情况下测量多个颗粒,交叉污染将是一个主要问题。因此,通常不采用显微ATR采样模式。
在ATR成像中,表面明显较大的ATR晶体与样品接触,并在整个晶体表面上进行ATR测量。
显微红外的测量模式
红外显微镜能够测量单个微观粒子,但其还有一个额外的优点,即能够以全自动模式运行来测量样品中的多个颗粒,也能够对整个样品(如完整的滤膜)进行绘图(map)或成像(image)。自动化应用于每种前述的不同的采样模式。显微镜还配有可视摄像机,以允许操作员查看其正在使用的样品,并设置位置进行分析。
点模式
在点模式下,软件允许用户选择一个或多个对应于颗粒的测量位置。然后,红外显微镜将驱动载物台至测量位置,以进行扫描,然后移动至下一个样品位置。如果样品含有少量颗粒,则上述方法可能是一种非常快的光谱收集方法。对于每个位置,软件控制的光阑大小应可视地包围颗粒,以避免杂散光。与标准红外光谱测量一样,需采用合适的背景扫描,并且应使用与样品扫描相同的孔径尺寸在红外显微镜上来执行。对于透射,应在无样品的空白区中测量背景。对于反射,应在反射基底的空白区中记录背景。对于ATR,应使用干净的晶体来测量背景。
软件内的颗粒检测算法能够分析可见图像来发现样品内颗粒的存在。然后,软件将自动扫描所有颗粒和适当背景的光谱。相对于手动选择分析位置,该方法具有显著的速度优势,或者,如果对整个样品进行绘图或成像,则可节省大量时间。图5所示为颗粒识别工具。
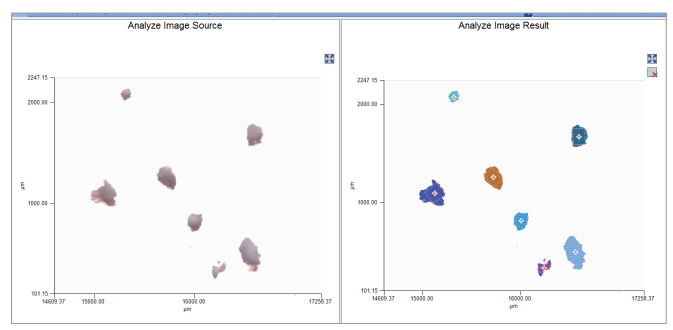
图5.分析图像发现存在的颗粒。
绘图(Mapping)
Mapping实验涉及定义待测量的样品面积(这可能是几毫米),以及定义整个样品上测量的X、Y间距。例如,如果样品为0.7 mm×1 mm,并且应每100微米进行一次测量,则Mapping实验将进行70次测量(7×10)。在每个点上收集红外光谱,并在整个面积上生成样品的红外图。
Mapping实验利用红外显微镜中存在的单点检测器(通常是MCT检测器),并将测量单个光谱、移动载物台、测量光谱,移动载物台。对于小样本区域或大XY间距,这已足够。但是,对于大样本区域(如滤膜),或测量小XY间距的非常小的颗粒,Mapping实验可能非常慢,并且需要很长时间。
成像(Imaging)
成像Imaging实验类似于绘图Mapping实验,不同之处在于成像实验使用具有元件阵列的检测器同时测量多个点,而非单个检测器元件,导致整体测量速度显著加快。阵列检测器可能是线性阵列或焦平面阵列。线性阵列具有几何形状n×1,其中n通常为16或32,而焦平面阵列具有几何形状n×n,其中n通常为16、64或128。焦平面阵列检测器的价格较高,并且其光谱截止值约为s/b 950 cm -1,以致于忽略某些重要的光谱信息,而线性阵列检测器具有低至s/b 600 cm -1的完整MCT光谱范围。
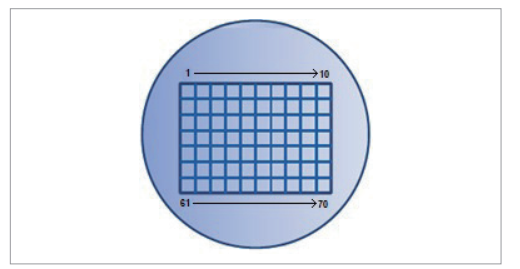
图6. Mapping实验收集一行数据点,然后移动至下一行,直至完成为止。
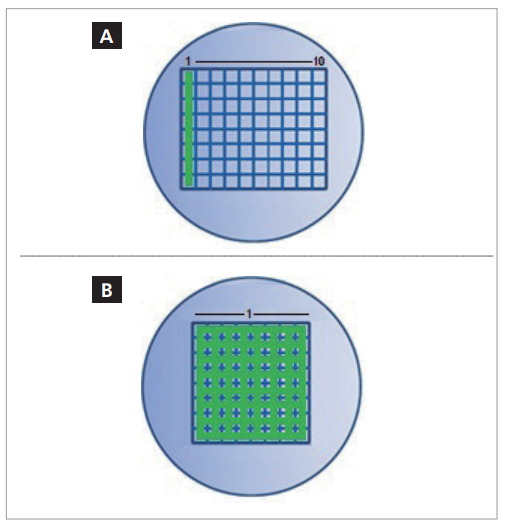
图7a和7b.(a)线性阵列检测器收集一“列”数据点,然后移动至下一“列”。(b)焦平面阵列检测器在一次测量中收集数列和数行数据点。
红外成像的一个示例如图8所示。
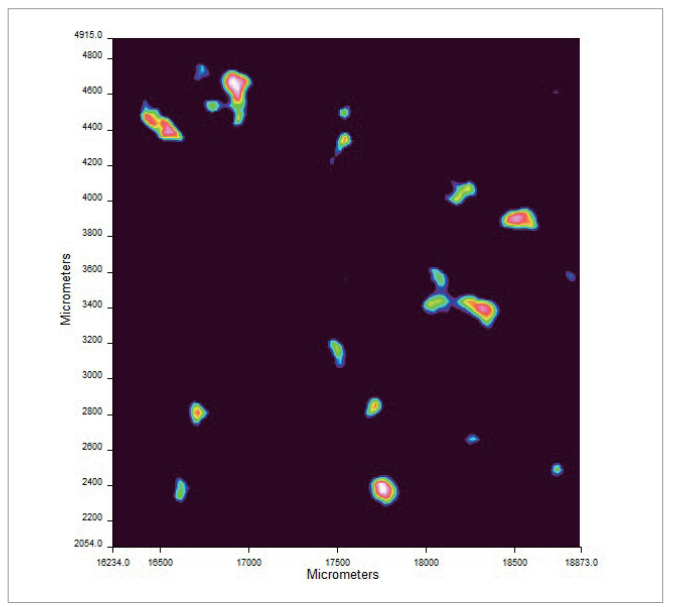
图8.从化妆品配方中过滤的微塑料颗粒的总红外吸光度图像。
在红外图像中的每个像素均有与之相关的完整的红外光谱。在点模式下工作时,系统将每个颗粒生成一个光谱。在图像模式下工作时,系统将每像素生成1个光谱,从而导致每次实验产生大量数据。例如,以6.25μm像素大小测量的10 mm×10 mm图像将包含超过250万个光谱。软件的各种处理工具均考虑到简化数据解析步骤,Z强大的是主成分分析(PCA)。在PerkinElmer光谱图像软件中,该分析法通过选Show Structure功能得以引用。该功能将使用PCA在样品内寻找不同的化学组分。不同的PCA组分将表示存在的不同材料,并针对不同组分生成图像,以指示样品内不同材料的分布位置。图9a-d所示为一个示例
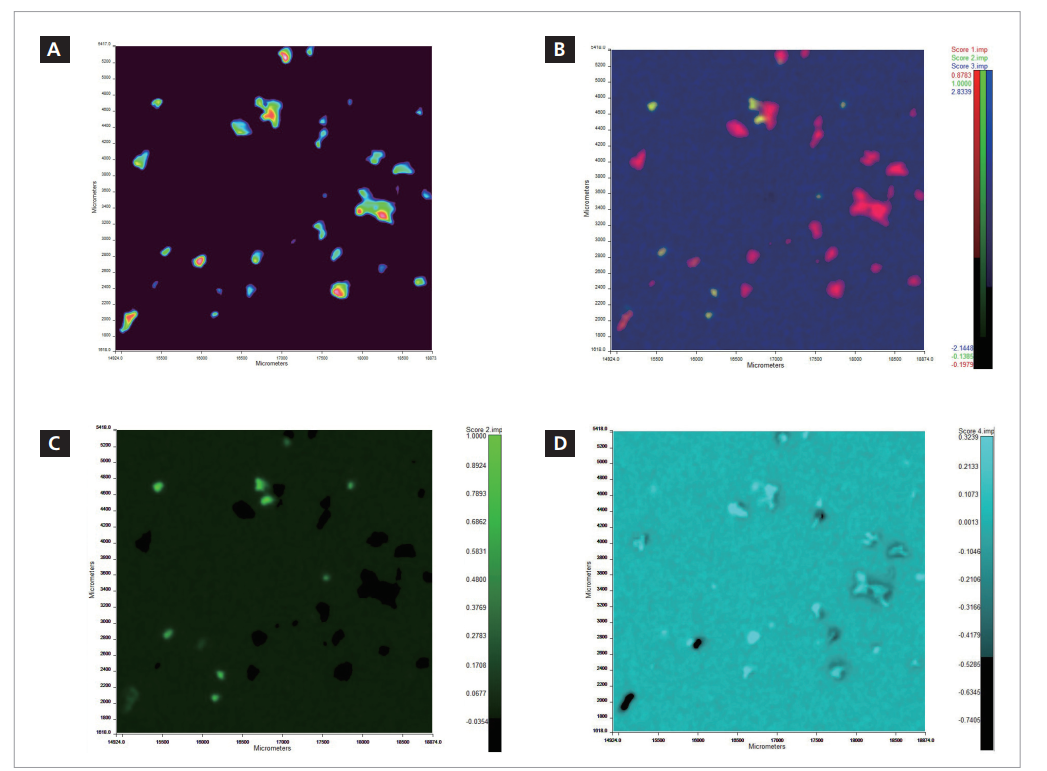
图9a-d.(a)总吸光度红外图像。(b)显示混合组分的PCA分析。不同的组分采用不同的颜色,以区分不同的化学成分类型。(c)2组分图像。(d)4组分图像。
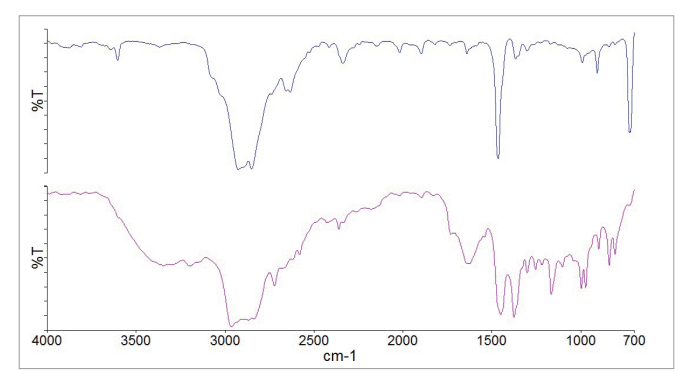
图10.观察到的颗粒光谱;组分4的图像即聚乙烯(顶部),以及组分2的图像即聚丙烯(底部)。
参考文献
1.J van Franeker et al,Environmental Pollution 159(2011)2609-2615.
2.Browne A.,2011,Accumulations of microplastic onshorelines worldwide:sources and sinks Environmental,Science and Technology.
3.Robertson I.,PerkinElmer Application Note 012079_01,“Detection and Identification of Microplastic Particles in Cosmetic Formulations Using IR Microscopy”.
4.https://www.stelray.com/reference-tables/, accessed 3rd August 2018.
5.Labo magazine–Oktober 2010,“Wasserverschmutzungdurch Mikroplastikpartikel”,www.labo.de.
6.Imhof,H.K.,et al,Limnology and Oceanography-Methods,10,524–537.
7.Liebezeit,G.,and Dubaish,F.(2012).Bulletin of Environmental Contamination and Toxicology,89(1),213–217.
8.Thompson,R.C.,et al,Science,304(5672),838.
9.Liebezeit,G.,and Dubaish,F.(2012).Bulletin of Environmental Contamination and Toxicology,89(1),213–217.
10.Claessens,M.,etal,Marine Pollution Bulletin,70(1–2),227–233.
11.Cole,M.,et al,Scientific Reports,4,4528.
 AutoTDS-Ⅲ型二次热解吸仪如何进行操作使用
AutoTDS-Ⅲ型二次热解吸仪如何进行操作使用

 评论
评论