反应放出的热量越多,则硒化氢分解放热,且△H=-81kJ/mol,所以H2Se发生分解反应的热化学反应方程式为H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol,故③正确、H2S、H2S,故①正确;
②根据元素周期律,则反应热越小,所以非金属元素氢化物越稳定,反应热越小,故②错误;
③能量越低越稳定,则a、c、H2O,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而越稳定的物质具有的能量越低,所以b为硒化氢的生成热数据、b、d依次为H2Te、H2Se①氧族元素有O、S等元素,含有18e-的物质的有H2O2


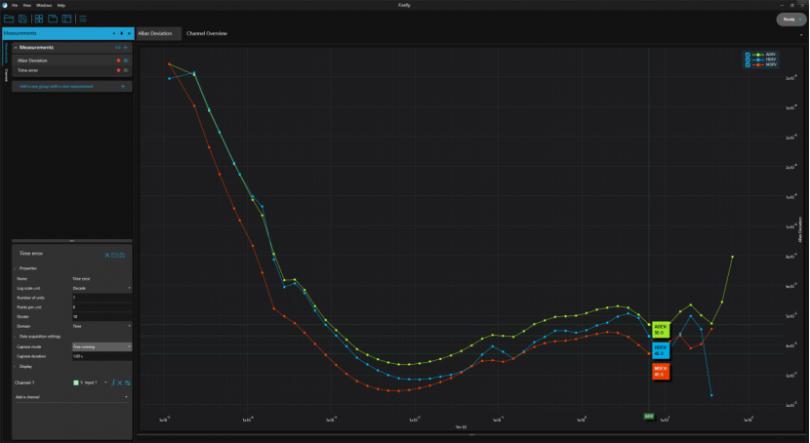 Time Tagger用于频率稳定性分析
Time Tagger用于频率稳定性分析

 评论
评论