而不选择其他分子呢,... 而不选择其他分子呢,
1803年英国化学家道尔顿(1766-1844)提出原子论后,受到科学界的普遍重视,原子论的核心是:每种元素以其原子的质量为其Z基本的特征。因此,测定相对原子质量的工作成为了当时化学科学的ZD任务。
道尔顿首先测定相对原子质量。他选定一种元素的原子质量作为参照标准。氢气Z轻,于是他选择了氢作为相对原子质量的基准,确定氢的相对原子质量为1。有了相对原子质量基准后,要测定其他元素的相对原子质量,必须知道化合物的质量、组成及化学式,如测得甲烷中含碳75%,含氢25%,又知甲烷的化学式为CH4,才能求出碳的相对原子质量。设碳的相对原子质量为A,则 ,故A=12。化合物的质量组成可以测定,但化学式在当时还无法确定。于是道尔顿做了大胆地、武断地、无任何实验依据的假设,如当时只知道氢氧只生成一种化合物,他认为此化合物必定是二元的。即水的组成为HO ,如碳和氧可生成两种化合物,则其一为二元的CO,另一为三元的CO2……等。由于水的组成确定错误,因此,根据当时对水中氢和氧的质量分析结果测出氢的相对原子质量为7。( )(1808年)与现代值相差甚远,从而导致了测定相对原子质量工作的一系列错误。尽管如此,道尔顿在提出测定相对原子质量的任务及确定一种元素作为相对原子质量的参照标准方面还是有贡献的。
瑞典化学家贝采里乌斯(1779-1848)致力于相对原子质量测定工作20多年,他在极简陋的实验室中对2000多种单质和化合物进行了准确的分析,为测定相对原子质量提供了丰富的实验依据。他对道尔顿武断地、无实验依据的假设水的组成为HO表示怀疑,而采用当时法国化学家盖吕萨克(1778-1850)发现的气体化合体积定律即“各种气体彼此起化学反应时,常以简单的体积比相化合。”作为确定化合物AmBn中m和n的依据。如2体积氢与1体积氧化合生成2体积水蒸气,从而正确地确定了水的组成应为H2O,而不是HO,这是相对原子质量测定工作的重大突破。因此,他所测定的相对原子质量比道尔顿准确得多。贝采里乌斯认为氢不与许多元素直接化合,而氧是能够与绝大多数元素直接化合的,所以,他决定采用氧的相对原子质量等于100作为相对原子质量的基准。
法国巴黎大学教授杜隆(1785-1838)和普蒂(1791-1820)曾专门从事对各种单质的比热测定,于1819年提出杜隆-普蒂原子热容定律“许多固体单质,尤其是金属,其比热与它们的相对原子质量常常成反比”。即固体单质相对原子质量x比热=常数(原子热容)。若氧的相对原子质量为1,则原子热容为0.38,若氧的相对原子质量为16,原子热容为6。根据固体单质的比热和原子热容即可测定相对原子质量。利用这一定律对贝采里乌斯测定的相对原子质量进行了核实和修正。
1819年贝采里乌斯的学生,米希尔希里(1794-1863)发现了同晶定律“相同数目的原子以相同方式相结合即得同晶型。”利用同晶定律可以推测化合物的组成,从而测定相对原子质量。例如已知铬酸盐与硫酸盐是同晶型的,则铬酸与硫酸有相似的化学组成:CrO3 与SO3而测得氧化低铬中氧为铬酸的一半。因此氧化低铬的化学组成应为CrO ,即为Cr2O3,故原来确定的CrO3有误。而氧化低铬与氧化铁又同晶型故原来确定FeO3也有误,应为Fe2O3。从而修正了原来测定铬、铁相对原子质量均为现代值2倍的错误。
1827年法国化学家杜马〔1800-1884〕根据阿伏加德罗(1776-1856)的假设“同温同压下同体积的不同气体含有相同数目的分子。”通过测定蒸气密度来测定相对分子质量,但他认为同时也可测定相对原子质量,本来根据阿假设 是合理的,但他却武断地假设“单质气体的密度之比,不仅等于相对分子质量之比,也等于它们的相对原子质量之比。”即 。这里暗示了一个错误,就是单质蒸气都与氢气一样为双原子分子。于是他根据砷、汞、磷、硫的蒸气密度测出的相对原子质量都发生了错误。实际上这些物质的蒸气分子都不是双原子分子。Z后不得不宣布用蒸气密度法测定相对原子质量不可靠。
1860年意大利化学家康尼查罗(1826-1910)在德国卡尔斯鲁厄国际化学家代表大会上论证了原子-分子学说。在根据蒸气密度法测定相对分子质量的基础上,提出一个合理的测定相对原子质量的方案:“因为一个分子中所含各种原子的数目必然都是整数,因此,在质量等于相对分子质量值的某物质中,某元素的重量一定是其相对原子质量的整数倍。如果我们考查一系列含某一元素的化合物,其中必有一种或几种化合物中只含有一个原子的这种元素,那么,在一系列该元素的质量值中,那个Z小值,即为该元素的大约相对原子质量。”
例如测定氮的相对原子质量时可分三步:
1.先将许多可蒸发的氮的化合物用蒸气密度法测定其相对分子质量。
2.测定一系列含氮化合物中氮的百分含量。
3.求出一分子中各种含氮化合物氮的含量,其中Z小值即为氮的相对原子质量。如:
含氮化合物
相对分子质量值
氮的百分含量
1分子中氮的重量
氨
17.05
82.28%
14.03
二氧化氮
45.66
30.49%
13.90
氧化二氮
44.13
65.70%
28.11
氧化氮
30
46.74%
14.02
以上数据中Z小值约为14,就是氮的相对原子质量。用这种方法测定相对原子质量即使化合物的化学式不知道,也可求出可靠的相对原子质量。
化学家为了求得精确的相对原子质量值,投入了大量的精力,进行了辛勤的劳动。Z早对相对原子质量进行精确测定的化学家是比利时的斯达(1813-1891),他广泛使用当时已经发展起来的各种制备纯净物质的方法将所测物质提纯,所用蒸馏水经过多次蒸馏,把天平的灵敏度提高到0.03毫克。因此,他所测定的一些元素的相对原子质量值与现代值相当接近。1860年,他又提出以氧的相对原子质量为16作为相对原子质量的基准,便于准确测定其他元素的相对原子质量,这一基准在化学上一直用了100年。
以后在相对原子质量精确测定上做出重要贡献的化学家还有美国的理查落(1868-1928),德国的霍尼施米特(1878-1945)。
1929年美国乔克和江斯登在天然氧中发现了17O和18O两种同位素。根据1940年比较精确的质谱测定,自然界中三种氧的同位素的丰度为:16O占99.75%;17O占0.037%;18O占0.204%。因此将天然氧作为相对原子质量的基准就出现了问题。当时物理学界随即改用16O为16作为相对原子质量的基准,但化学界仍采用天然氧为16作为相对原子质量的基准。
当用16O=16作为基准时,氧的各种同位素的相对原子质量分别为16O=16.0000,17O=17.0045,18O=18.0049,所以自然界中氧的平均相对原子质量为:
16.000×99.759%+17.0045×0.037%+18.00.49×0.204%=16.0044
这样一来物理上采用的原子质量与化学上沿用的原子质量就出现了下列比值:
16.0044/16=1.000275
化学相对单位= 1.000275×物理相对单位。化学相对单位要比物理相对单位大万分之三。这样一来使各种元素的化学相对数值比物理相对数值小。因此化学相对与物理相对之间的换算关系为:
物理相对=1.000275×化学相对质量
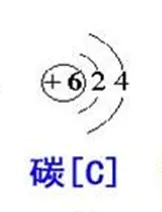
为了求得相对基准的统一,1959年国际纯粹与应用化学联合会(IUPAC)在德国慕尼黑开会,会上根据德国物理学家马托赫(1895-1976)的建议改用工12C=12 (即 12 C=1)作为相对基准,并经得国际纯粹与应用物理联合会(IVPAP)的同意于1961年8月正式采用12 C=12作为相对的基准。同年发布了新的相对原子质量表。
采用12C= 12为相对新基准的原因主要是12C在自然界中丰度比较稳定,碳的化合物特别是有机化合物繁多,它形成很多高质量的“分子离子”和氢化物利于测定质谱,而用质谱仪测定相对是现代Z准确的方法。采用新的12 C= 12基准后所有元素的原子量变动都不大,仅比过去减小了百万分之四十三。
到目前为止,用质谱法测定相对是Z精确的,现在国际相对委员会每两年公布一次修订的相对,越来越多地采用质谱法测定的结果。
我国化学家,中科院院士,北京大学张青莲教授是我国参加国际纯粹与应用化学联合会、相对与同位素丰度委员会委员。张青莲等人于1991、1993、1995年测定的铟、锑、铈、铕的相对被国际上采用为相对数据标准。这是我国化学家对相对测定工作作出的贡献。

 石墨烯 “新材料之 王”竟成为神经电生理研究新选择,为什么它拥有无限潜力?
石墨烯 “新材料之 王”竟成为神经电生理研究新选择,为什么它拥有无限潜力?

 评论
评论