企业性质生产商
入驻年限第10年
主要功能
单独或同步测量叶绿素荧光和 P700
两个光系统的诱导动力学曲线(包括快相和慢相)
两个光系统的快速光曲线和光响应曲线
淬灭分析、暗驰豫分析
典型的 P700 曲线测量
通过叶绿素荧光和 P700 的同步测量获知两个光系统的电子传递动力学、电子载体库的大小、围绕 PSI 的环式电子传递动力学等
通过测量 P515/535 信号变化测量跨膜质子动力势 pmf 及其组分跨膜质子梯度 ΔpH 和跨膜电位 Δψ
“P515 Flux”信号能原位反映活体样品处于稳态的偶联电子和质子的流动速率
通过测量 NADPH 荧光估算 NADP 的还原程度
通过测量 9-AA 荧光来估算跨膜质子梯度 ΔpH
测量参数
PS II参数: Fo, Fm, F, Fm’, Fv/Fm, Y(II) 即 △F/Fm’, Fo’, qP, qL, qN, NPQ, Y(NPQ), Y(NO) 和 ETR(II) 等
PS I参数: P700, Pm, Pm’, P700red, Y(I), Y(ND), Y(NA) 和 ETR(I) 等
P515/535参数:质子动力势pmf,跨膜质子梯度 ΔpH,跨膜电位 Δψ 等
NADPH/9-AA参数:NADP 的还原程度,ΔpH 等
其他测量参数:Post-Illumination(鼓包),PQ-Pool(PQ库)等
应用领域
相当于两台 PAM-101/ 102/ 103 的功能,可同时测量光系统II活性(调制叶绿素荧光)和光系统I活性(P700 吸收变化),可用于、植物生理学、农学、林学、园艺学等领域光合作用机理研究。
扩展模块 P515/535 可测量跨膜质子动力势 pmf 及其组分跨膜质子梯度 ΔpH 和跨膜电位 Δψ 等,是叶绿素循环和光保护研究的强大工具。
扩展模块NADPH/9-AA,可测量 NADPH 荧光和 9-AA 荧光,估算 NADP 的还原程度和跨膜质子梯度 ΔpH。
主要技术参数
主机:通用型(DUAL-C),可接标准检测器,可扩展 P515/535,NADPH/9AA 等多种模块。
P700 双波长测量光:LED,830 nm 和 875 nm
PSII 荧光测量光:LED,460 nm(DUAL-DB)或 620 nm(DUAL-DR)
红色光化光:LED 阵列,635 nm;ZD连续光强 3000 μmol m-2 s-1
蓝色光化光:LED,460 nm;ZD连续光强 1100 μmol m-2 s-1
单周转饱和闪光(ST):200000 μmol m-2 s-1,5~50 μs 可调
多周转饱和闪光(MT):20000 μmol m-2 s-1,1~1000 ms 可调
远红光:720nm
选购指南
一、高等植物叶片测量基本款
系统组成:通用型主机,标准版检测单元,数据线,工作台,软件等
注意:高等植物叶片测量红光检测器(Dual-DR)和蓝光检测器(Dual-DB)可任选其一
|
| 高等植物叶片测量基本款 |
二、悬浮样品测量基本款
系统组成:通用型主机,标准版检测单元,悬浮液的光学单元,数据线,工作台,软件等
注意:藻类测量时,蓝藻请选择红光检测器(Dual-DR),其他藻类可选蓝光检测器(Dual-DB)
|
|
| 悬浮样品测量基本款 | |
|
|
|
| 同步测量 PSII(红色)和 PSI(蓝色)的诱导曲线 | 同步测量 PSII(红色)和 PSI(蓝色)的光响应曲线 | 典型的 P700 测量曲线 |
|
|
|
| 打开饱和脉冲时叶绿素荧光信号(红色)和 P700(蓝色)信号变化 | 以线性时间测量的荧光快速动力学曲线 | 以对数时间测量的荧光快速动力学曲线 |
三、其他扩展模块
扩展测量一:P515/535模块
 | P515/535 模块是 WALZ 公司为 DUAL-PAM-100 设计的测量模块,可以直接连接 DUAL-PAM-100 的主机,测量 550-510 nm 的差式吸收以及 535 nm 波长的信号变化。P515/535 模块可以测量光合器官的跨膜质子动力势(pmf)、跨膜电位(Δψ)、跨膜质子梯度(ΔpH)和玉米黄素(Zea)变化等内容。此外,该模块还提供一种特殊的 “P515 Flux” 操作模式,可让光化光以光-暗脉冲形式打开-关闭(1/1调制光/暗),原位测量活体样品处于稳态的偶联电子和质子的流动速率。 | ||
|
|
| |
| 通过测量 P515 变化得出质子动力势(pmf)两个组分 Δψ 和 ΔpH | 通过测量535 nm变化得出质子动力势(pmf)及其组分ΔpH | 同步测量P515和535 nm信号的光响应曲线 | |
扩展测量二:NADPH/9-AA 模块
NADPH/9-AA 模块是 WALZ 公司为 DUAL-PAM-100 设计的测量模块,可以直接连接 DUAL-PAM-100 的主机,测量 NADPH 荧光和 9-AA 荧光。NADPH 荧光可用于估算 NADP 的还原程度,9-AA 荧光用于估算跨膜质子梯度 ΔpH。该模块的一个很大特色是与标准探头联用,在国际上DY次做到了同步测量叶绿素荧光与 NADPH 荧光。
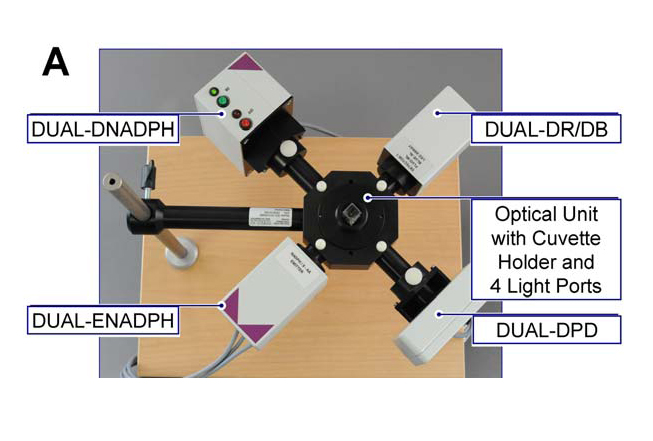 | 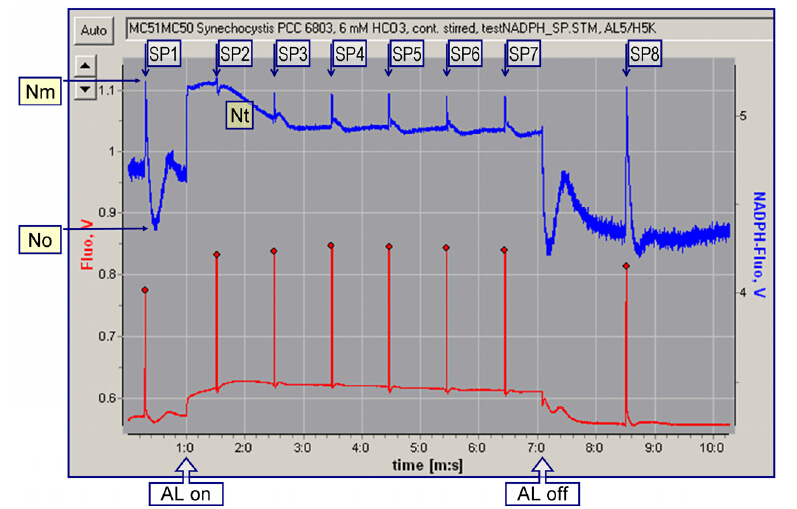 | ||
| NADPH 探头图示 | 同步测量 NADPH 荧光(蓝色)与叶绿素荧光(红色) |
扩展测量三:与光合仪 GFS-3000 联用
 |  |
|
专为 DUAL-PAM-100 与 GFS-3000 的同步测量设计,由特制叶室(带温度和PAR传感器)、风扇、导光杆、电子盒与支架构成。同步测量时,光源完全由 DUAL-PAM-100 的测量头提供,气体交换由 GFS-3000 的红外分析器检测,P700 和叶绿素荧光由 DUAL-PAM-100 的检测器测量。 |
四、其他可选附件
1,Dual-DPD:单独的光电二极管检测器单元,通过导光杆连接到 ED‑101US/MD 上,配置 NADPH 模块时推荐选配。
2,Dual-DPM:单独的光电倍增管检测器单元,用于较稀的悬浮液荧光测量,需要装配到 ED-101US/MD 上使用。必须要同时配置测量头 DUAL-DB 或 DUAL-DR 来激发调制荧光。
3,ED-101US/T: 控温装置,安装在 ED-101US/MD 上,为悬浮液控温;可外接循环水浴来控温,
4,US-SQS/WB: 球状微型光量子探头,可插入样品杯中测量 PAR;由主机 DUAL-C 控制。
5,PHYTO-MS:磁力搅拌器,连接到光学单元 ED-101US/MD 的底部对悬浮液进行搅拌。
6,DUAL-OP:拟南芥等小叶片测量用适配器,特制透光小孔适配器套装,直径 7 mm、5 mm 和 3 mm,对于拟南芥等小叶片的 P700 测量非常重要!
产地:德国 WALZ
数据来源:光合作用文献 Endnote 数据库,更新至 2021 年 1月,文献数量超过 10000 篇
原始数据来源:Google Scholar
1. Chovancek, E., et al. (2021). "The different patterns of post-heat stress responses in wheat genotypes: the role of the transthylakoid proton gradient in efficient recovery of leaf photosynthetic capacity." Photosynth Res.
2. Grinberg, M. A., et al. (2021). "Effect of chronic β-radiation on long-distance electrical signals in wheat and their role in adaptation to heat stress." Environmental and Experimental Botany 184: 104378.
3. Huang, W., et al. (2021). "The water-water cycle is not a major alternative sink in fluctuating light at chilling temperature." Plant Science: 110828.
4. Méteignier, L.-V., et al. (2021). "Arabidopsis mTERF9 protein promotes chloroplast ribosomal assembly and translation by establishing ribonucleoprotein interactions in vivo." Nucleic Acids Research.
5. Wang, Q., et al. (2021). "Effects of sulfur limitation on nitrogen and sulfur uptake and lipid accumulation in Scenedesmus acuminatus." Journal of Applied Phycology.
6. Wang, Z., et al. (2021). "Characterization and functional analysis of phytoene synthase gene family in tobacco." BMC Plant Biology 21(1): 32.
7. Amstutz, C. L., et al. (2020). "An atypical short-chain dehydrogenase–reductase functions in the relaxation of photoprotective qH in Arabidopsis." Nature Plants 6(2): 154-166.
8. Bag, P., et al. (2020). "Direct energy transfer from photosystem II to photosystem I confers winter sustainability in Scots Pine." Nature communications 11(1): 6388.
9. Basso, L., et al. (2020). "Collaboration between NDH and KEA3 Allows Maximally Efficient Photosynthesis after a Long Dark Adaptation." Plant Physiology 184(4): 2078-2090.
10. Fréchette, E., et al. (2020). "Variation in the phenology of photosynthesis among eastern white pine provenances in response to warming." Global change biology n/a(n/a).
11. Fu, H.-Y., et al. (2020). "The availability of neither D2 nor CP43 limits the biogenesis of photosystem II in tobacco." Plant Physiology.
12. Galvis, V. C., et al. (2020). "H+ transport by K+ EXCHANGE ANTIPORTER3 promotes photosynthesis and growth in chloroplast ATP synthase mutants." Plant Physiology.
13. He, L., et al. (2020). "Primary Leaf-type Ferredoxin1 Participates in Photosynthetic Electron Transport and Carbon Assimilation in Rice." Plant Journal n/a(n/a).
14. Ishikawa, N., et al. (2020). "PsbQ-Like Protein 3 Functions as an Assembly Factor for the Chloroplast NADH Dehydrogenase-like Complex in Arabidopsis." Plant and Cell Physiology.
15. Kalra, I., et al. (2020). "Chlamydomonas sp. UWO 241 exhibits high cyclic electron flow and rewired metabolism under high salinity." Plant Physiology: pp.01280.02019.
16. Kusano, M., et al. (2020). "Cytosolic GLUTAMINE SYNTHETASE 1; 1 modulates metabolism and chloroplast development in roots." Plant Physiology.
17. Lee, K., et al. (2020). "Lack of FIBRILLIN6 in Arabidopsis thaliana affects light acclimation and sulfate metabolism." New Phytologist 225(4): 1715-1731.
18. Li, H., et al. (2020). "A rice chloroplast-localized ABC transporter ARG1 modulates cobalt and nickel homeostasis and contributes to photosynthetic capacity." New Phytologist n/a(n/a).
19. López-Calcagno, P. E., et al. (2020). "Stimulating photosynthetic processes increases productivity and water-use efficiency in the field." Nature Plants 6(8): 1054-1063.
20. Reiter, B., et al. (2020). "The Arabidopsis Protein CGL20 is Required for Plastid 50S Ribosome Biogenesis." Plant Physiology.
21. Sanz-Luque, E., et al. (2020). "Metabolic control of acclimation to nutrient deprivation dependent on polyphosphate synthesis." Science Advances 6(40): eabb5351.
22. Shinde, S., et al. (2020). "Glycogen Metabolism Supports Photosynthesis Start through the Oxidative Pentose Phosphate Pathway in Cyanobacteria." Plant Physiology 182(1): 507-517.
23. Storti, M., et al. (2020). "Regulation of electron transport is essential for photosystem I stability and plant growth." New Phytologist n/a(n/a).
24. Treves, H., et al. (2020). "Multi-omics reveals mechanisms of total resistance to extreme illumination of a desert alga." Nature Plants.
25. Yang, Q., et al. (2020). "Two dominant boreal conifers use contrasting mechanisms to reactivate photosynthesis in the spring." Nature communications 11(1): 1-12.
26. Zhang, C., et al. (2020). "Structural insights into NDH-1 mediated cyclic electron transfer." Nature communications 11(1): 888.
