企业性质生产商
入驻年限第9年
| 波长范围: | 400-1700nm |
| 光谱分辨率: | 5.5/8nm |
| 图像分辨率: | 1024 |
| 帧速: | 330/670 |
PhenoTron® PTS植物表型成像分析系统,采用PTS(Plant-To-Sensor)植物自动传送技术,集成高光谱成像技术及FluorCam叶绿素荧光成像、多光谱荧光成像技术,可选配RGB成像及红外热成像,样品依次自动传送相应成像工作站,采集多传感器表型成像大数据,实现一站式、高通量、无损伤反射光成像、叶绿素荧光成像、多光谱荧光成像及红外热辐射成像分析等。
 主要应用于:
主要应用于:
l 作物表型成像分析
l 种质资源检测
l 遗传育种
l 抗性筛选
l 植物生理生态研究
l 藻类表型研究
l 光生物学研究
l 果实蔬菜品质检测
主要特点:
1) PTS(Plant-to-Sensor)技术平台,SpectraScan©高精度ZL移动扫描平台,样品可放置在JZ位移平台上自动运送成像单元进行一站式成像分析
2) 多传感器成像,标配包括VNIR高光谱成像、FluorCam叶绿素荧光成像、多光谱荧光成像,可选配900-1700nm高光谱成像、红外热成像、Thermo-RGB©成像或高倍放大RGB成像(具备显微成像功能)
3) 多激发光,调制多光谱光源板,7位滤波轮等,可实现植物及藻类不同光源培养光生物学研究、光合生理研究
4) 可选配叶绿素荧光高光谱成像分析、UV-MCF高光谱活体荧光成像分析
5) 可对培养植株、叶片、果实、种子萌发与种苗、根系及藻类等进行表型性状成像检测分析
6) 组合命令+位置记忆:可一键保存、读取、删除当前位置,自动移动JZ定位,精度优于1mm,适用于周期性重复移动扫描,可设置10条protocols命令,实现系统自动运行
7) 主机箱:全中文操作系统,PC端GUI软件界面,可实现远程操控,内置10寸触控屏,全波段对称成像光源,0-100%线性调控,角度、高度可调,集开关控制、平台控制、杂散光隔离于一体,确保光场均一、稳定的ZJ测量环境
8) 系统有效行程:Z轴高度400mm,有效扫描面积大于1200×300mm
主要技术指标:
1) 叶绿素荧光成像:
a) 专业高灵敏度高分辨率叶绿素荧光成像CCD,帧频20fps,分辨率1360×1024像素,binning2x2:680 x 512像素
b) A/D转换分辨率:16比特、65536级灰阶;像素大小6.45×6.45µm
c) 具快照模式和叶绿素荧光动态视频模式
d) 标配617nm和6500K冷白双色光化学光,ZD光化学光2000µmol.m-2. s-1,可选配3000µmol.m-2. s-1
e) 饱和脉冲4000µmol.m-2. s-1,可选配6000µmol.m-2. s-1
f) 可选配365nm或385nm紫外光、447nm品蓝、470nm蓝色、530nm绿色、505青色、627nm红色、660nm深红、590nm琥珀色、740nm远红等不同光源
g) 可自动运行Fv/Fm、Kautsky诱导效应、荧光淬灭分析、光响应曲线等protocols
h) 50多个叶绿素荧光自动测量分析参数,包括:Fv/Fm、Fv’/Fm’、Y(II)、NPQ、qN、qP、Rfd、ETR等,自动形成叶绿素荧光参数图
i) 自动同步显示叶绿素荧光参数及参数图、叶绿素荧光动态曲线、叶绿素荧光参数频率直方图
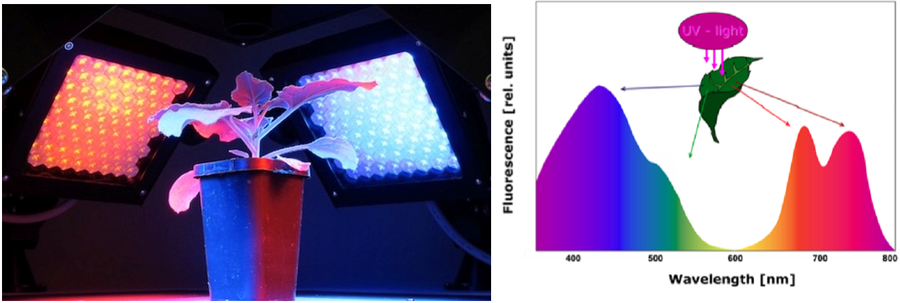
2) 多光谱荧光成像:紫外光激发多光谱荧光成像,反映多酚与黄酮类等次级代谢产物动态变化、叶绿素动态变化、植物衰老、植物病虫害胁迫及非生物胁迫等
a) 高分辨率CCD镜头,1392x1040像素,有效像素大小为6.45μm,可像素叠加(binning)以提高灵敏度(2x2,3x3,4x4)
b) 7位滤波轮及滤波器,用于测量多光谱荧光F440、F520、F690、F740及其它生物荧光现象及GFP等不同波段稳态荧光成像
3) 自动测量分析功能(无人值守):可预设1个或2个试验程序,系统可自动测量储存,比如白天自动定时运行Kautsky诱导效应程序,夜间自动定时运行荧光淬灭分析程序
4) 可选配GFP/YFP等稳态荧光成像,或选配LUC荧光素酶成像
5) 叶绿素荧光成像与多光谱荧光成像具Live(实况测试)、Protocol(实验程序选择)、Pre-processing(成像预处理)、Result(成像分析结果)等菜单,Protocol实验程序可自由编辑,也可利用Protocol菜单中的向导程序模版客户自由创建新的实验程序
6) 高光谱成像站:标配为400-1000nm高光谱成像分析,可选配900-1700nm或1000-2500nm
a) 波段数:224通道
b) 光谱分辨率:FWHM 5.5nm
c) 空间分辨率:1024x
d) 数值孔径:F/1.7
e) 可成像测量分析作物生化、生理指标如叶绿素含量、花青素含量、胡萝卜素含量、光利用效率、健康指数、覆盖度、胁迫等近百种光谱指数

由左到右依次为:小麦N素与水份状态高光谱成像分析(Brooke Bruning等);小麦耐盐碱高光谱成像检测(Ali Moghimi等,2018);小麦镰刀菌抗性检测(E. Alisac等,2018)
7) 红外热成像(选配):
a) 分辨率:640×512像素,可选配其它高分辨率红外热成像传感器
b) 测量温度范围:-25℃-150℃
c) 灵敏度:0.03℃(30mK)@30℃
d) 光谱范围:7.5-13.5μm
e) 传感器:非制冷红外焦平面感应器,已多点校准(具校准证书)
f) 1-14倍数码变焦
g) 软件具备调色板(自然、彩虹、灰度、梯度等14种颜色组合)、差值技术、温度范围设置(以改变颜色分布或突出选择范围等)、等温线模式、选区分析(点、线、多边形等)、温度扫描(显示所选线的温度分布曲线等)、剖面温度、时间图等;具备报告模式等;
8) RGB成像(选配):高灵敏度RGB成像,1-40倍放大,可进行micro和macro成像分析,可选配其它高分辨率成像传感器
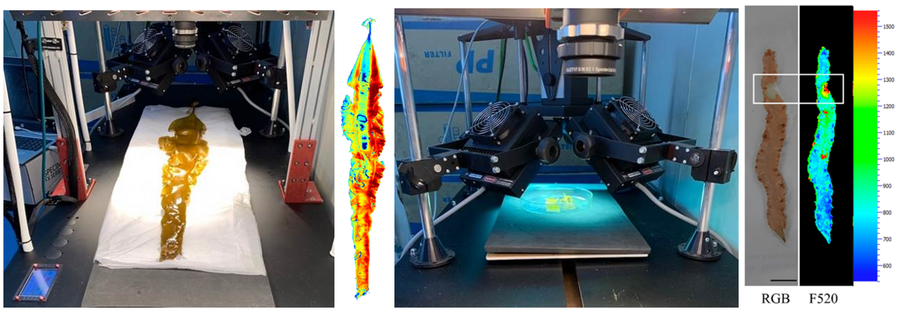
易科泰工程师在中国海洋大学现场对培养的海带进行高光谱成像分析和叶绿素荧光成像分析(右图为紫菜多光谱荧光成像分析,引自:Lei Tang, Liping Qiu, Cong Liu, Guoying Du,Zhaolan Mo, Xianghai Tang,Yunxiang Mao.Transcriptonic Insights into Innate Imunity Responding to Red Rot Disease in Red Alga Pyropia yezoensis. Molecular Sciences,2019)
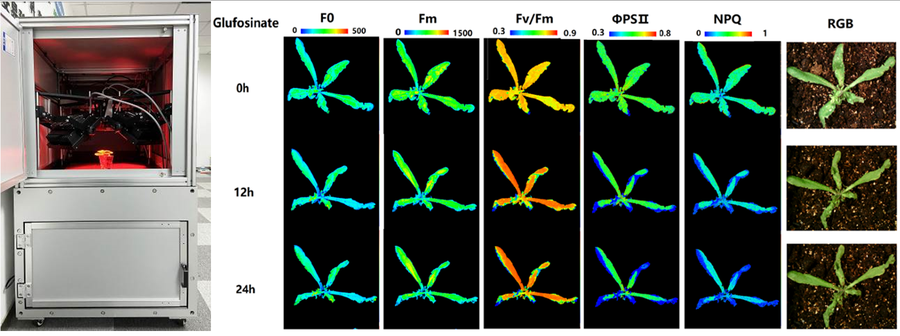
左图为PhenoTron® PTS植物传送叶绿素荧光成像和高光谱成像站进行成像分析;下右图为草铵膦对拟南芥光合生理影响(叶绿素荧光成像分析,由EcoTech®实验室提供)
应用案例:生菜幼苗病害快速无损检测与抗性品种鉴定
农作物在种子萌发生长过程中会遭遇各种病害,因此对高抗病性品种的选育非常重要。而如果能快速、无损、简便、可靠地检测病害的发生,甚在病害症状发生前就能够将其检测到,无论是对于缩短育种周期还是指导生产实践都具有非常重要的意义。
德国莱布尼茨蔬菜和观赏植物研究所IGZ的Sandmann研究组将刚发芽的生菜幼苗人工感染立枯丝核菌(Rhizoctonia solani),然后综合采用叶绿素荧光成像技术、多光谱荧光成像技术、红外热成像技术及植物反射光谱NDVI成像,对不同成像参数进行了分析,以确定哪些技术的哪些参数能够更灵敏地将感染病害的植株和未感染的植株区分开,实现高通量非损伤在线分析测量筛选:
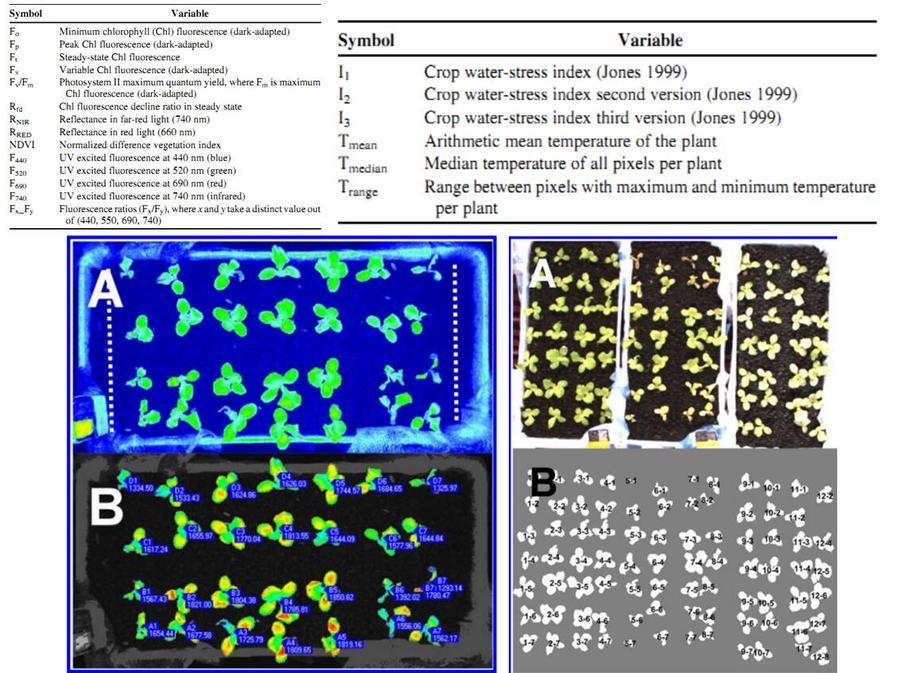
结果发现,感染病害的植株和未感染的植株之间,ZD光化学效率Fv/Fm、荧光衰减指数Rfd、NDVI、作物水胁迫指数I1、光合有效叶面积日相对生长速率Arel、多光谱荧光F440、F520等参数都表现出显著差异。通过进一步数据统计分析ZZ发现Fv/Fm、Rfd在本次实验中的识别效果,误差≤0.052,Fv/Fm>0.73的生菜幼苗即可认为是健康的。研究人员希望通过进一步工作,将这一发现应用于园艺和农业生产实践,比如优良抗病蔬菜品种的选育、病害的早期发现与FZ等。
参考文献:
1)Ali Moghimi etc. A Novel Approach to Assess Salt Stress Tolerance in Wheat Using Hyperspectral Imaging. Frontiers in Plant Science, 2018
2) Brooke Bruning etc. The development of Hyperspectral distribution maps to predict the content and distribution of nitrogen and water in wheat. Frontiers in Plant Science, 2019)
3)E.Alisaac etc. Hyperspectral quantification of wheat resistance to Fusarium head blight: comparison of two Fusarium species. Eur J Plant Pathol, 2018
4) Sandmann M, et al. 2018. The use of features from fluorescence, thermography and NDVI imaging to detect biotic stress in lettuce. Plant Disease 102: 1101-1107
1101-1107
