发布:
睿科集团股份有限公司时间:
2023-12-30行业:
仪器仪表 仪器仪表因生物制品多是使用非人源的连续传代菌株或细胞株来表达生产,即使经过严格的纯化工艺仍然容易在成品中残留宿主细胞的DNA片段。宿主残留DNA会带来各种不可控的潜在风险。因此,残留DNA的含量不仅是产品质量的一个重要指标,更是与安全性密切相关。宿主DNA残留量是生物制品各质量控制标准的重中之重。
宿主残留DNA风险
致瘤性
宿主细胞基因组序列可能插入人体染色体,激活原癌基因(如Ras癌基因)或抑 制抑癌基因。
传染性
宿主细胞DNA中可能存在病毒(如HIV病毒)基因组,整合到人体基因组能够扩增产生传染性病毒粒子。
免疫源性
微生物来源的基因组DNA富含CpG和非甲基化序列,可能增加免疫反应诱导产生DNA抗体。
宿主残留DNA标准
WHO、FDA、EMA及我国的NMPA等监管机构对生物制品成品的宿主DNA残留量都有严格的限制,其在生产过程中的清除情况是监管的重要内容。

宿主残留DNA检测方法
各国药典提供了数种宿主DNA残留量的检测方法,主要包括杂交探针法、阈值法、荧光染料法和qPCR法。随着法规要求的日趋严格,杂交探针法、阈值法和荧光染料法已不能满足产品质量控制的要求,正逐步被发达国家药典淘汰。qPCR法具有特异性强、灵敏度高、重复性好,能够实现快速定量检测的技术优势,已经成为残留DNA检测的未来趋势。《美国药典》43版将qPCR法作为生物制品宿主残留DNA检测的唯 一方法,《中国药典》2020年版也在通则3407 外源性DNA残留量测定法中新增定量PCR法。
睿科集团推出自主研发的生物制品宿主DNA残留检测试剂盒,满足各国监管机构的法规要求,为工艺研究开发和生产质量控制提供准确可靠的检测手段,助力生物制品行业发展。
产品介绍
生物制品宿主细胞残留DNA前处理试剂盒(磁珠法)
用于生物制品样品的前处理,适用于提取各种生物制品的中间品、原液、半成品和成品中残留的宿主 DNA。
* 可手工提取,亦可搭配睿科仪器实现自动化前处理。
 |
|
生物制品宿主细胞残留DNA检测试剂盒(qPCR-探针法)
对使用样本前处理试剂盒提取的样本中的残留DNA进行荧光探针qPCR定量。
· CHO残留DNA检测试剂盒
· E.coli残留DNA检测试剂盒
· 毕赤酵母残留DNA检测试剂盒
· Vero残留DNA检测试剂盒
· Human 残留DNA检测试剂盒(即将上市)
· 293T残留DNA检测试剂盒(即将上市)
产品优势
■ 特异性强、结果准确、重复性好
■ 宽线性范围,灵敏度高
■ 与《中国药典》2020年版,《美国药典》43版,《欧洲药典》10.0版方法一致
■ 溯源至国家标准品(1)
■ 通过《中国药典》通则9101和ICH Q2(R1)方法学验证
■ 组分简单,操作简便快捷
■ 高通量,适配睿科生物制品自动化前处理系统
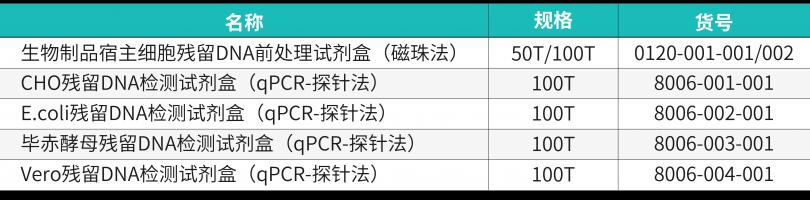
产品规格
参考文献
[1] WHO. WHO Expert Committee on Biological Standardization: Forty-seventh Report. Requirements for the use of animal cells as in vitro substrates for the production of biologicals. World Health Organization Technical Report, 1998, 878.
[2] FDA. Points to Consider in the Manufacture and Testing of Monoclonal Antibody Products for Human Use. 1997.
[3] European Pharmacopoeia Commission. European pharmacopoeia 10.0. 2020.
[4] 国家药典委员会. 中国药典(三部). 2020.
注:(1)无毕赤酵母DNA定量国家标准品








