发布:
北京易科泰生态技术有限公司时间:
2023-04-25行业:
农林牧渔 综合斑马鱼作为一种模式动物,与人类共享高达 70% 的基因组,保留了多达 80% 的人类疾病相关蛋白。同样作为一种脊椎动物,斑马鱼与人类的组织和发育生物学过程相似,故而针对各种癌症、肝病、血液疾病、心脏病和行为障碍的斑马鱼模型被建立起来,斑马鱼进而成为了基因表达调控、发病机理、药物筛选领域的主要模式动物,在生物医学研究的地位越来越重要(Patton et al., 2021)。

北京易科泰提供生物医学领域斑马鱼呼吸代谢及行为分析的全套技术方案,包括斑马鱼成鱼和鱼卵、胚胎、幼鱼的呼吸代谢测量、斑马鱼视频跟踪和行为分析及游泳能力评估。具体测量参数及应用方向如下:
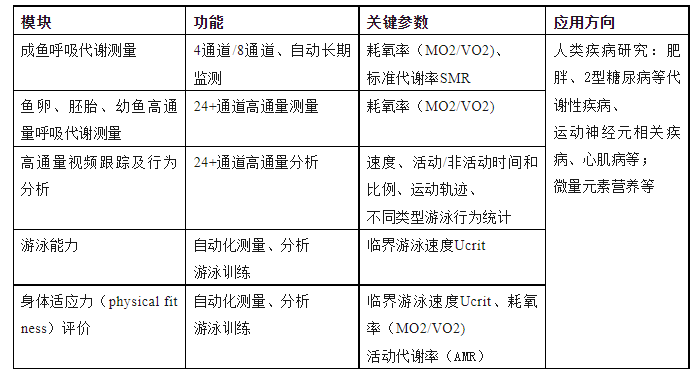

模块1.成鱼呼吸代谢测量
斑马鱼幼鱼及成鱼呼吸代谢测量系统采用了经典的间歇式(Intermittent flow/stop-flow)测量法,兼具高时间分辨率和长期监测的特点。针对斑马鱼体长短、体重轻、耗氧量低等特点,采用了小型的呼吸室、水泵及非接触式的光学氧气传感器,确保获得可靠的耗氧曲线和耗氧率数据。系统具备自动控制、测量和分析的功能,放入斑马鱼样品、设置间歇测量各阶段的时间后,系统即可自动运行和计算耗氧率,研究人员也可借助配套软件计算标准代谢率(SMR)等数据。

易科泰公司提供同时自主集成的斑马鱼呼吸测量系统,可自动切换小型水泵的开闭状态,实现了自动化间歇式测量。溶解氧监测采用了荧光光纤氧气传感器,具备高灵敏度和高分辨率,并且易安装、零维护。
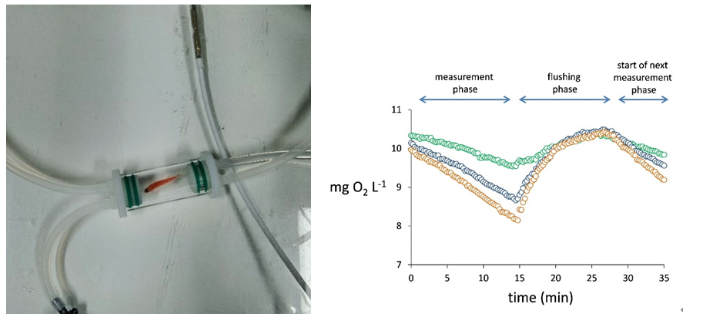
模块2. 鱼卵、胚胎、幼鱼高通量呼吸代谢测量
斑马鱼鱼卵、胚胎、幼鱼呼吸代谢测量由内置氧气感应贴片的24孔板、氧气测量主机、密封配件等组成,多个氧气测量主机可串联组成最 多240个通道的高通量测量系统。
应用案例
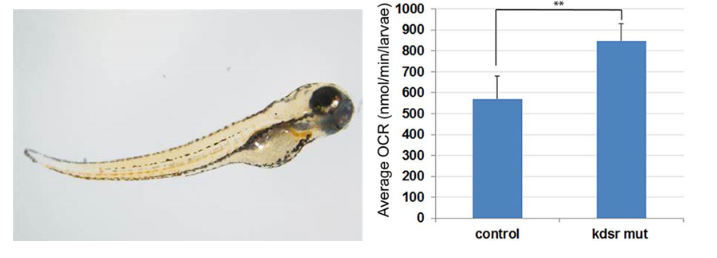
因与哺乳动物具有功能相似的肝脏细胞和与人类相似的脂质代谢,斑马鱼是研究肝病的有效模型。南卡罗莱纳医科大学的研究人员在KDSR(3-酮-二氢鞘氨醇还原酶)突变体斑马鱼中发现了肝病表型过程,并对其发病机制进行了研究。发现KDSR缺失导致鞘脂补救途径的代偿性激活和磷酸鞘氨醇(S1P)的积累,进而导致线粒体活性增加、氧化应激和内质网应激以及随之而来的肝细胞损伤。因此KDSR可能是一种新的脂肪变性和肝损伤的遗传风险因子(Park et al., 2019)。该研究中的耗氧实验便采用了斑马鱼鱼卵、胚胎、幼鱼呼吸代谢测量系统,实现了幼鱼耗氧率的高通量、快速测定。先在24孔板的每个孔加入125μL的卵水,在24℃下运行20min,之后放入3条幼鱼,立即使用封口膜密封和硅胶垫压实。使用配套软件记录,每3min记录一次溶解氧浓度,持续30min。根据溶解氧浓度随时间的变化计算了耗氧率,下图展示了对照组和突变体各3条幼鱼的7次测量结果。发现相比于对照组斑马鱼,KDSR突变体的耗氧率有所升高,该结果支持KDSR突变体线粒体β-氧化增强的结论。
模块3. 高通量视频跟踪及行为分析
斑马鱼视频跟踪和行为分析系统由高清高帧频工业相机、斑马鱼行为分析软件、斑马鱼活动室/池等组成。先录制高质量斑马鱼活动视频,再在计算机上使用专业行为分析软件对视频中的斑马鱼进行分析,获得其随时间变化的行为轨迹(X坐标和Y坐标;单条斑马鱼可做3D跟踪,包括X、Y、Z坐标),最 后自动计算获得数十种行为学参数。基于机器视觉的斑马鱼行为分析系统,能够对24孔、48孔、96孔板中的斑马鱼进行高通量行为采集和分析,使研究者轻松获得大量行为数据。
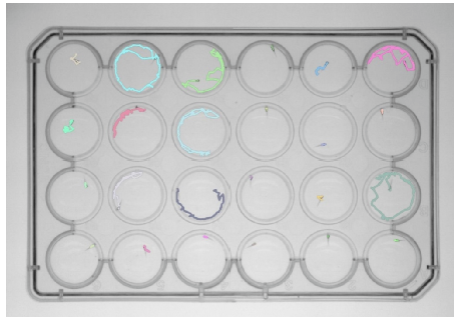
应用案例
肌萎缩侧索硬化(Amyotrophic lateral sclerosis,ALS) 是最常见的缓慢进展性运动神经元疾病,以肢体和延髓上、下运动神经元损害并存为特征,临床表现为进行性四肢骨骼肌萎缩、无力、肌束震颤,并伴有肌张力增 高、腱反射亢进、病理征阳性,最 终呼吸衰竭死亡,患者平均生存期为3~5年。
大部分ALS病例为散发型,但仍有约10%的病例为遗传型,由不同基因突变引起。超氧化物歧化酶1(SOD1)基因突变是主要致病基因,约占遗传型病例的20%。SOD1在大部分组织中广泛表达,主要参与自由基清除。尽管SOD1相关的ALS发病机制已有报道,但SOD1突变诱导的病理学机制尚不得而知。为此,高丽大学医学院的研究人员构建了能够在成熟少突胶质细胞中表达携带G93A突变的人SOD1的转基因斑马鱼,并考察了其病理特征和对运动神经元的影响(Kim et al., 2019)。
该研究中的行为分析使用了斑马鱼视频跟踪和行为分析系统:将成年斑马鱼逐条转移至1L的水箱中,令其适应30min后,使用摄像机从侧面记录斑马鱼的游泳行为,获得了平均游泳速度、非活动时间(休息时间)、在水箱底部花费的时间等参数,并对感兴趣的行为(包括静止、异常活动、趋触性和运动缺陷)的时间进行了统计分析。
发现在8个月之前,SOD1突变斑马鱼和野生型斑马鱼的游泳速度无明显差异;在早期症状阶段(8个月-11个月),SOD1突变体斑马鱼的平均游泳速度有所增加;直到疾病晚期SOD1突变斑马鱼游泳速度降低。且在早期症状阶段,大部分SOD1突变斑马鱼表现出焦虑样行为失常,包括趋触性、静止和异常活动以及轻微的运动缺陷。除此之外,在14个月大的时候,SOD1突变斑马鱼休息的时间占比更大,表明其运动活性降低。

模块4. 游泳能力
斑马鱼游泳能力研究测试系统为一站式方案,包括斑马鱼专用小型游泳室和自动化水流速度控制、校准的所有软硬件。系统提供适合斑马鱼游泳匹配的高精度控制水流,水流调节速度为0.7 - 50 cm/s。该系统能够实现水流速度的校准、转换、校正和控制,单位和方式任选(如以BL/sec为单位的游泳速度),可对Solid Blocking效应(斑马鱼自身阻碍水流引起的水流速度变化)进行校正,并且能够创建自动化的用户自定义程序。

应用案例
心肌病是指心肌在缺血、高血压等外在压力和基因突变等内在压力的作用下发生结构改变,最 终导致心力衰竭的心脏疾病。心肌病包括肥厚性心肌病(HCM)、扩张性心肌病(DCM)和限制性心肌病(RCM)等类型。30%~50%的DCM患者有基因突变和家族遗传背景;80%~90%为常染色体显性遗传。高效、高通量的动物模型对于评估相关候选基因、加快新基因发现过程具有重要作用。
美国梅奥医学医院的研究人员利用基因组编辑技术得到了已知心肌病基因Gatad1被敲除的斑马鱼(Yang et al., 2016)。在游泳能力测试环节,为增加成年斑马鱼对心力衰竭的易感性,对野生型和突变斑马鱼同时进行高胆固醇饮食和乙醇处理。饥饿24小时后,将斑马鱼放入游泳室。以9 cm/s(200rpm)的速度适应20min后,水流速度以8.66 cm/s (100 rpm) (Ui)的增量递增,每个速度梯度持续2.5min(Tii)。当斑马鱼力竭,无法从下游恢复游泳时,记录最 大游泳速度(Uii)和测试的总时间(Ti)。之后使其恢复30min,测量体长BL。临界游泳速度根据以下公式计算:
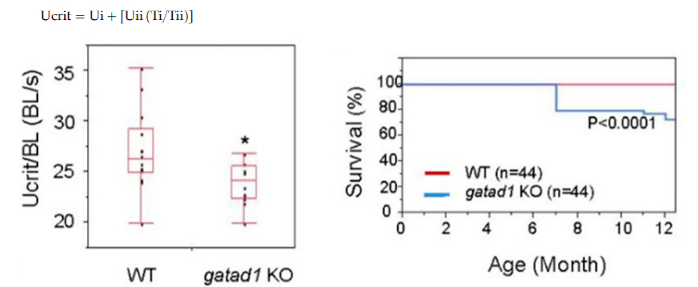
上述测量结果显示突变体的游泳能力相比于同龄野生型显著降低,并且突变斑马鱼在大约7个月大时开始死亡,与同龄野生型对照鱼相比,其存活率显著下降。该结果支持GATAD1是DCM诱发基因的结论。
模块5. 身体适应力(physical fitness)评价
斑马鱼身体适应力(physical fitness)评价系统将游泳能力研究测试功能和呼吸代谢测量功能相结合,通过测定游泳速度-耗氧率的变化曲线评估斑马的体力和身体适应性。

应用案例
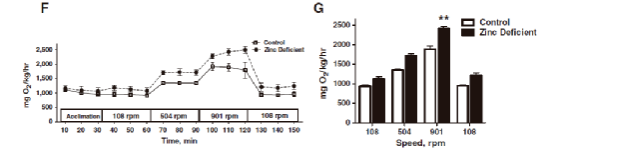
锌是人体必需的微量营养成分,在酶活性、免疫功能、神经功能和繁殖等生物过程中起到重要作用。孕妇缺锌是一个公共卫生问题:据估计全世界高达82%的孕妇锌摄入量不足。缺锌既与早产、低出生体重和先天性畸形的增加有关,也与后代葡萄糖耐受性受损、糖尿病易感性增加以及学习和记忆受损有关。和人类一样,斑马鱼也需要摄入锌,并且有类似的调节机制来维持锌的动态平衡。因此,美国俄勒冈州立大学的研究人员专门为斑马鱼开发了一种缺锌饲料,用其饲养成年斑马鱼导致其缺锌。研究结果表明亲代缺锌会使其后代也缺锌,并对后代产生死亡率显著增加、体力活动减少等不利影响。缺锌斑马鱼胚胎中调节金属内稳态的基因(包括锌转运体、金属调控转录因子)表达发生了变化,与糖尿病和胰 腺发育相关的基因表达有所下降。缺锌子代的DNA甲基转移酶表达下降,意味着亲代缺锌可能导致其子代的表观遗传图谱发生改变。该研究提供了数据支持,证明了缺锌孕妇补充锌是有益(Beaver et al., 2017)。该研究测量了不同水流速度下的成年斑马鱼氧气消耗率,以评估其身体适应力:以8条成年斑马鱼为一组,放入2.5L的游泳仪,每10min测量一次。采用间歇式的测量方式,具体时间设置为60s等待、240s冲洗、300s测量。先使斑马鱼适应30min,随后的30min使其在5cm/s(108rpm)的水流速度下自由游动,接着分别将水流速度设置成25 cm/s(504 rpm)和45cm/s(901 rpm),最 后恢复至5cm/s(108rpm)的水流速度。每个流速梯度持续30min。取线性相关性高于0.8的数据点进行分析。如下图,在适应阶段,对照组和缺锌斑马鱼的耗氧率没有差异。随着水流速度的提升,缺锌斑马鱼游动更剧烈,导致其耗氧率显著升高。重要的是斑马鱼表现出显著的饮食效应,即缺锌斑马鱼比对照组消耗更多的氧气——在最 高水流速度(901rpm)时缺锌斑马鱼要多消耗28%的氧气。因此,缺锌导致斑马鱼身体适应度(physical fitness)降低。
参考论文
1.Beaver, L.M., Nkrumah-Elie, Y.M., Truong, L., Barton, C.L., Knecht, A.L., Gonnerman, G.D., Wong, C.P., Tanguay, R.L., and Ho, E. (2017). Adverse effects of parental zinc deficiency on metal homeostasis and embryonic development in a zebrafish model. The Journal of Nutritional Biochemistry 43, 78–87. https://doi.org/10.1016/j.jnutbio.2017.02.006.
2.Kim, S., Chung, A., Na, J.E., Lee, S.J., Jeong, S.H., Kim, E., Sun, W., Rhyu, I.J., and Park, H. (2019). Myelin degeneration induced by mutant superoxide dismutase 1 accumulation promotes amyotrophic lateral sclerosis. Glia. 23669. https://doi.org/10.1002/glia.23669.
3.Park, K.-H., Ye, Z., Zhang, J., Hammad, S.M., Townsend, D.M., Rockey, D.C., and Kim, S.-H. (2019). 3-ketodihydrosphingosine reductase mutation induces steatosis and hepatic injury in zebrafish. Sci Rep 9, 1138. https://doi.org/10.1038/s41598-018-37946-0.
4.Patton, E.E., Zon, L.I., and Langenau, D.M. (2021). Zebrafish disease models in drug discovery: from preclinical modelling to clinical trials. Nat Rev Drug Discov 20, 611–628. https://doi.org/10.1038/s41573-021-00210-8.
5.Yang, J., Shah, S., Olson, T., and Xu, X. (2016). Modeling GATAD1-Associated Dilated Cardiomyopathy in Adult Zebrafish. JCDD 3, 6. https://doi.org/10.3390/jcdd3010006.