
立即扫码咨询
联系方式:400-099-8212
联系我们时请说明在仪器网(www.yiqi.com)上看到的!
前言
在单抗的发酵、纯化和存储过程中,因为酶或者非酶的条件,导致单抗存在一系列翻译后修饰,例如单抗类制品的脱酰胺化、N端焦谷氨酸基团修饰、异构化、唾液酸化聚糖和C端赖氨酸裁剪等蛋白质修饰作用都会导致电荷变异体的形成,而某些电荷变异体由于对单抗稳定性及其生物学功能发挥具有重要的影响而成为关键质量属性( CQA) ,在药品稳定性研究、上市申报及批放行检验等环节都需要进行研究或检测,因此对治 疗性单抗进行电荷变异体分析和控制十分必要。又如,轻链N30的脱酰胺造成赫赛汀轻微的效价丢失,重链N55的脱酰胺造成该药物效价的显著降低。在这些翻译后修饰中,很多会导致抗体电荷的变化,即形成电荷异构体。
传统的的电荷异构体分离方法包括离子交换和电泳法。两种方法分离机理不同,离子交换法根据抗体表面电荷的不同使用盐梯度或pH梯度进行分离,而电泳法根据抗体净电荷的不同进行分离,包括平板胶电泳(IEF)、毛细管等电聚焦电泳(CIEF)、自由流电泳(FFE)、成像毛细管等电聚焦电泳(iCIEF)等,其中iCIEF法已收录进入2020版中国药典(通则3129)用于等电点及电荷变异体含量测定。对于抗体酸碱异构体的充分表征,有利于对所开发抗体进行更深入的了解,进而指导生产工艺、纯化工艺的进一步优化。从NDA申报的角度,也必须对单抗电荷变异体进行充分研究。
因此,随着抗体行业的不断优化,对酸碱变异体的定性分析需求日益增长。常规的离子交换法和iCIEF法都用UV作为检测器。但UV检测器仅依靠保留时间定性,无法对没有对照品的组分进行归属。由于常规离子交换法和iCIEF方法使用难挥发性的盐作为流动相或者添加剂,造成这两种方法难以与定性Z 为强大的检测器-MS兼容。如离子交换法用氯化钠和磷酸盐作为流动相添加剂,iCIEF方法使用甲基纤维素和尿素作为添加剂。发展MS兼容的电荷异构体分离方法对抗体行业的生产技术优化和抗体质量研究有着重要的意义,因此近年来,各研究结构和研究人员开始关注该领域。
中国食品药品检定研究院(NIFDC)研究团队发表了iCIEF与高分辨质谱在线联用(iCIEF-HRMS),以及IEX与高分辨质谱的在线联用(SCX-HRMS)的对比工作(原文参考链接见文末)。作者对这两种技术的分离度、灵敏度、柱上残留和定性准确性上进行了系统对比。随后,作者将iCIEF-HRMS技术用于了9种等电点不同的单抗的电荷异构体分析。对于iCIEF常见的柱寿命和柱批次重复性问题也做了考察和说明。
实验材料及方法
表1展示了本文中使用的九种mAb等电点及iCIEF分析溶液体系配比,SCX-MS分析中各个mAb对应的色谱梯度见表2。iCIEF-MS在线直连分析,其连接示意图如图1所示。iCIEF-HRMS和SCX-HRMS中使用的高分辨质谱均以Orbitrap为检测器。
表1. 用于研究的九种mAb等电点及iCIEF分析溶液体系配比。

表2. SCX-MS分析所用色谱梯度。


图1 iCEF-MS在线直连系统连接示意图。
结果与讨论
iCIEF和SCX对9种单克隆抗体的分离效果
经过方法优化后,分别使用iCIEF-UV和SCX-UV技术,每个mAb的电荷变异体均可在10分钟之内得到分离(图2)。对于多数样品,iCIEF的分离效果要优于SCX。以infliximab为例,使用iCIEF,4个电荷异质体峰及主峰能实现基线分离,而SCX的分离稍逊;pembrolizumab,atezolizumab及denosumab也能观察到类似现象。

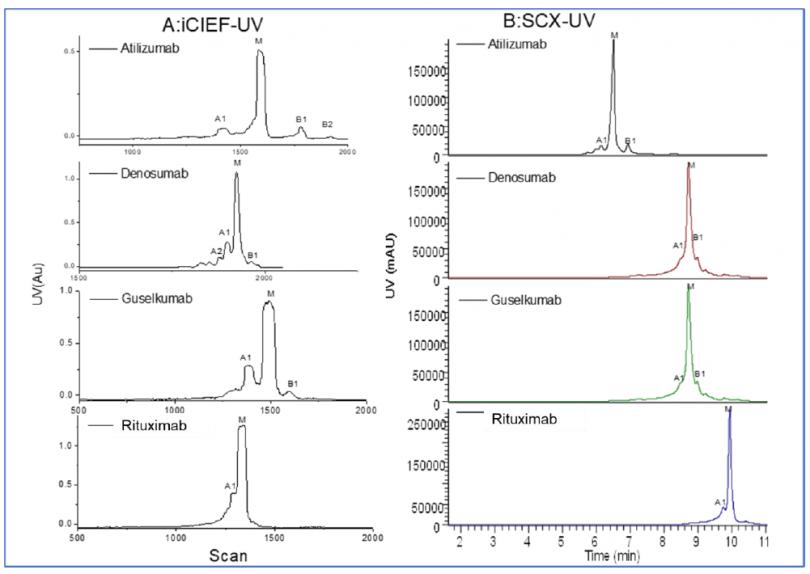
图2. 九种mAb iCIEF-UV及SCX-UV谱图对比。
iCIEF-MS及SCX-MS谱图对比
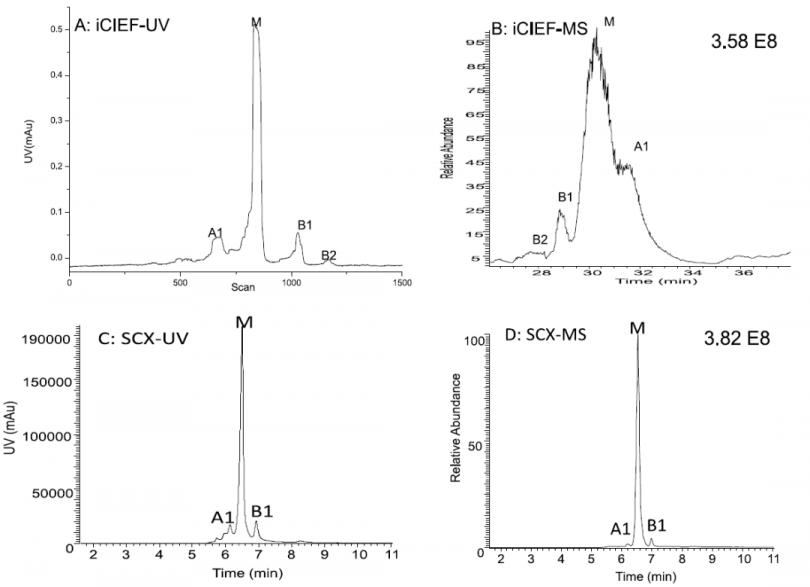
图3. Atezolizumab iCIEF-MS及SCX-MS谱图对比。左,UV检测器(280nm)谱图。右,质谱总离子流图(TIC)。UV检测器与质谱为在线串联模式。
图3展示了分别使用iCIEF-MS及SCX-MS对atezolizumab电荷变异体进行鉴定的结果对比。对于SCX分离,其出峰顺序在UV和MS两个检测器上是一致的。需要注意的是,当使用iCIEF作为分离手段时,UV图上Z 右边的碱峰会Z 先被推入质谱中,所以iCIEF-UV和iCIEF-MS的酸-碱峰顺序呈镜像关系。相较于iCIEF-MS,SCX-MS可以维持较窄的峰宽和较对称的峰型 。SCX-MS的峰轮廓与SCX-UV较为接近。此外,SCX-MS分析时使用常规流速(200~300μL/min),10-15 min即可完成一个样品的电荷异构体分析。iCIEF-MS分析时需要先分离聚焦,聚焦完成后再推出卡柱检测,样品从卡柱推出的液体流速50~100nL/min,整体的分离检测时间较长(每个样品1 h左右)。iCIEF-MS加上辅助鞘液后Z 终离子源处流速范围在5~10μL/min,低流速导致的峰展宽效应比较明显,尤其是主峰,可能会与酸峰有一定程度的重叠。使用窄pH范围的电解质和新材料涂层的分离卡柱可以在一定程度上克服峰展宽导致的分离度损失。
低流速为iCIEF-MS带来了峰展宽效应和分析检测时间长的问题,但使用低流速的iCIEF-MS相对于使用常规流速的SCX-MS具有更高的灵敏度。如图4所示,以atezolizumab为例,仅需约1/10的上样量,iCIEF-MS即可达到与SCX-MS相同的质谱响应信号强度。得益于Orbitrap平台的高灵敏度(图4C),在样品浓度仅为0.05mg/mL时,对于每个电荷变异体,仍可得到高信噪比的质谱谱图用于完整分子量分析。
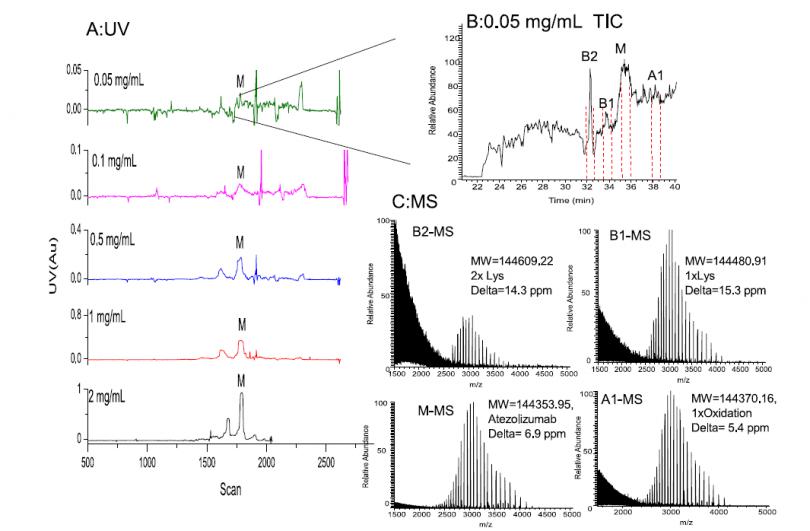
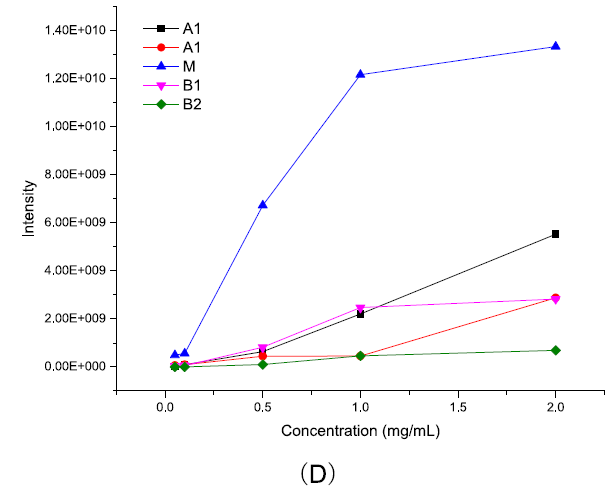
图4. 使用iCIEF-MS对atezolizumab进行表征。(A),浓度0.05-2mg/mL atezolizumab的iCIEF-UV谱图。(B),总离子流(TIC)图。(C),质谱图。(D),蛋白浓度v.s.质谱响应强度。
在质量精度方面, iCIEF-MS和SCX-MS均具有较好的表现。但由于iCIEF-MS在酸性条件下检测,不会造成明显的溶剂加合效应,而SCX-MS在近native的状态下洗脱,存在一定的溶剂加合,因此iCIEF-MS分析的质量精度稍优于SCX-MS(表3)。
表3. iCIEF-MS与SCX-MS分析
atezolizumab电荷变异体结果对比。
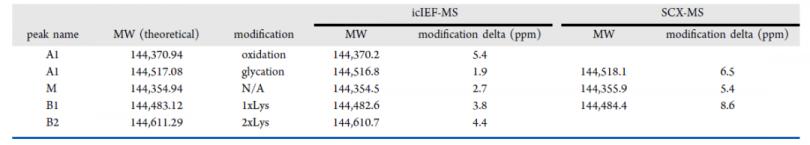
用atezolizumab评估iCIEF-MS在蛋白鉴定中的重现性
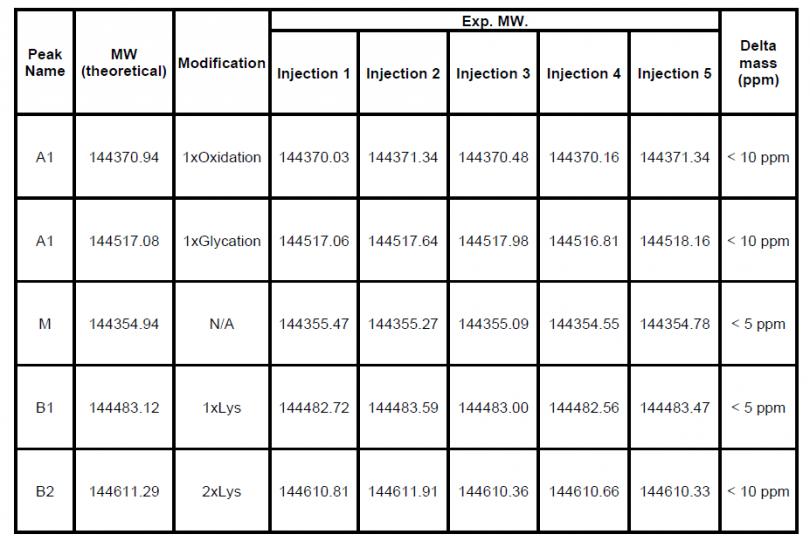
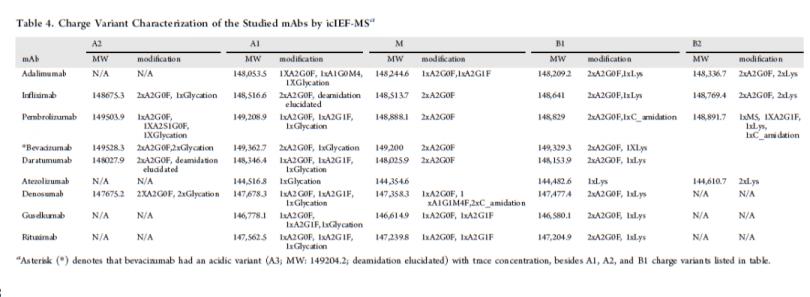
图6展示了五针atezolizumab重复进样(第 一天进样两针,第二天进样三针)用于评估iCIEF-MS系统重现性的结果。所有进样中电荷变异体的质量偏差均小于10 ppm(表4),证明iCIEF-MS的重现性可以满足批次间样品对比的需求。
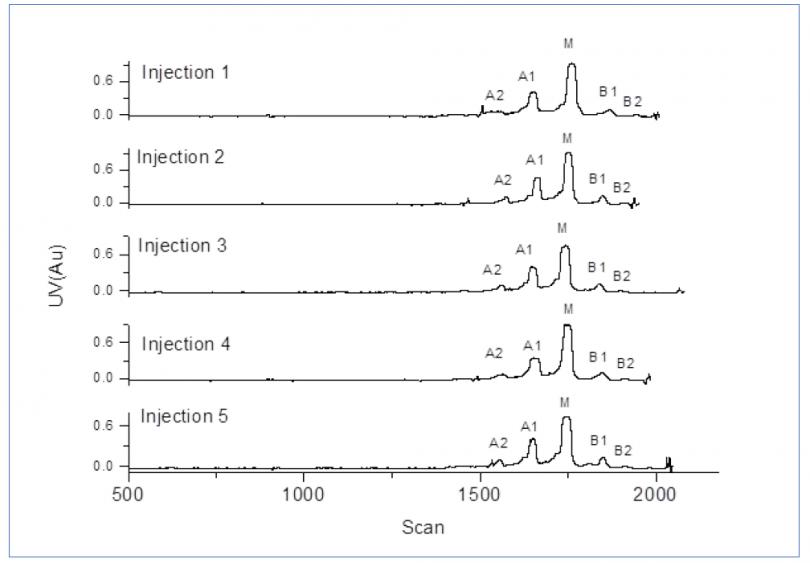
图6. 使用atezolizumab评估iCIEF-MS系统重现性(n=5)。总共进样五针,其中第 一天两针,第二天三针。
表4. iCIEF-MS分析atezolizumab
电荷变异体分子量稳定性(n=5)
iCIEF-MS分析多种mAb
研究人员使用iCIEF-MS技术,对表1中所列的9种mAb电荷异质性分别进行了分析,包括糖化在内的多种重要修饰均得到了鉴定。图7展示了9种mAb的iCIEF-UV与iCIEF-TIC对比图,表5则列出了9种mAb所有鉴定到的电荷变异体。
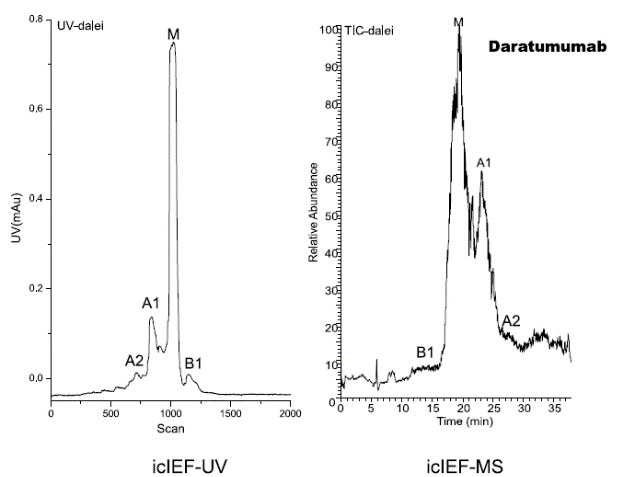
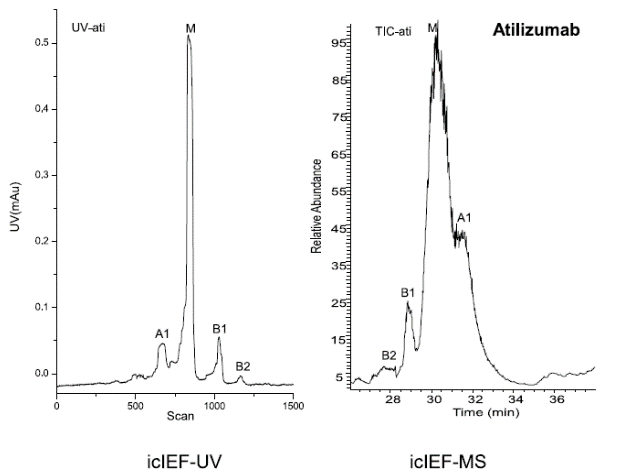
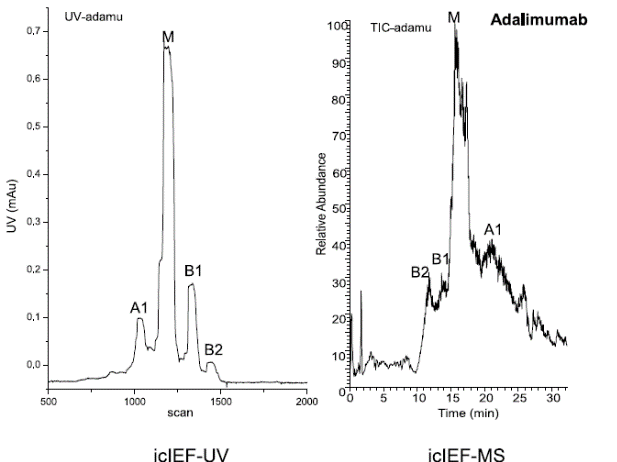
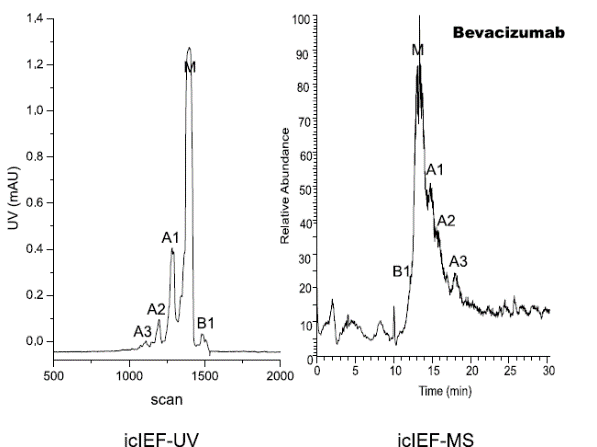
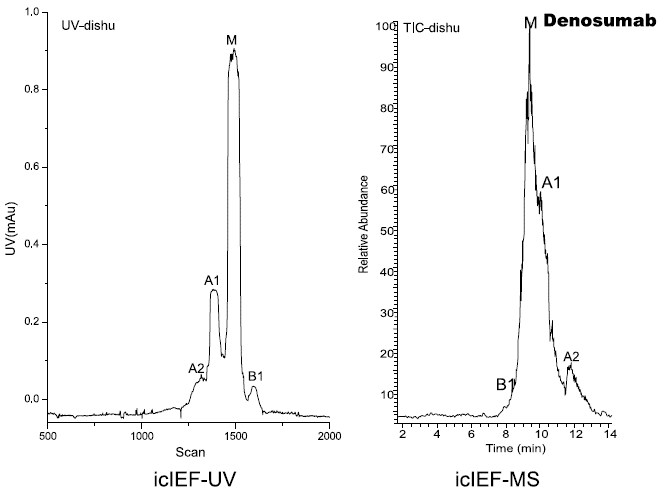
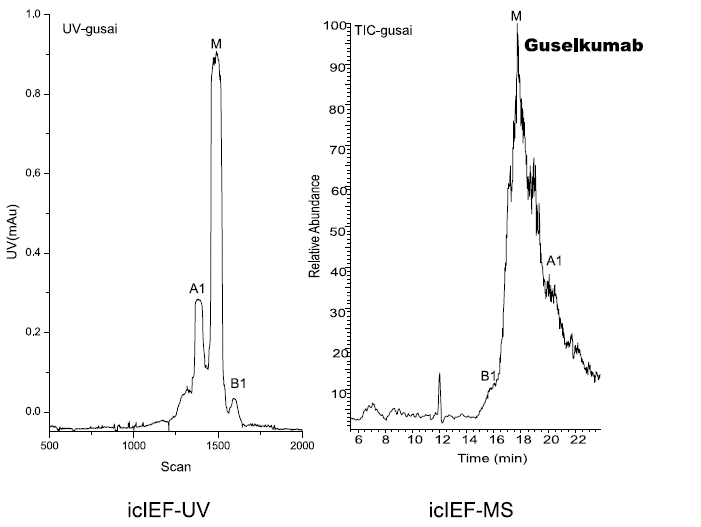
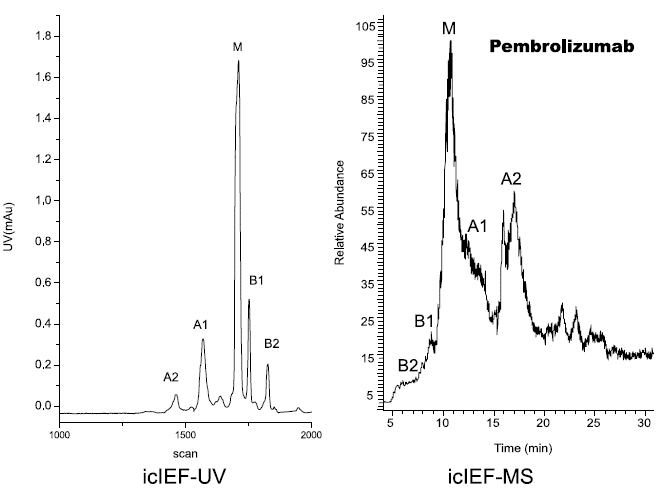
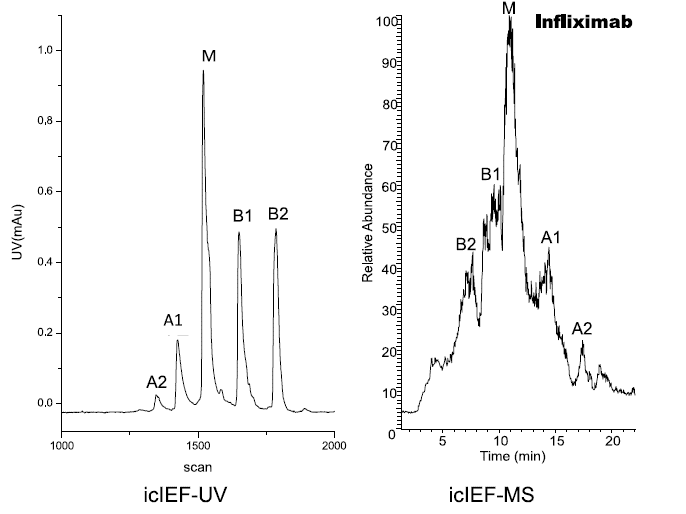
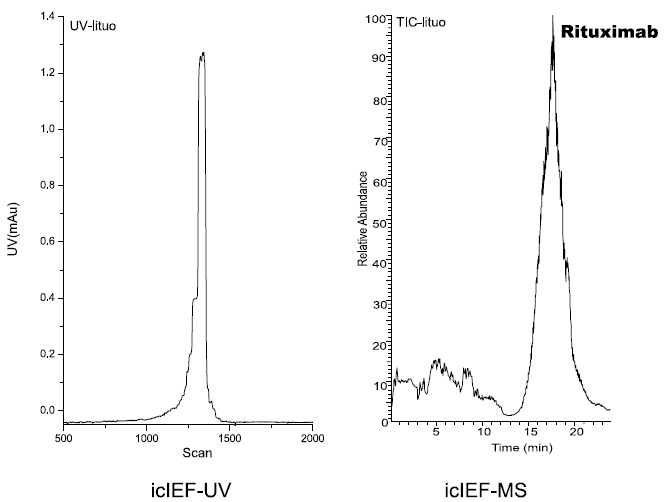
图7. 9种mAb的iCIEF-MS分析结果汇总。
表5. iCIEF-MS分析9种mAb的电荷变异体分子量列表汇总
延伸阅读(非文献内容)
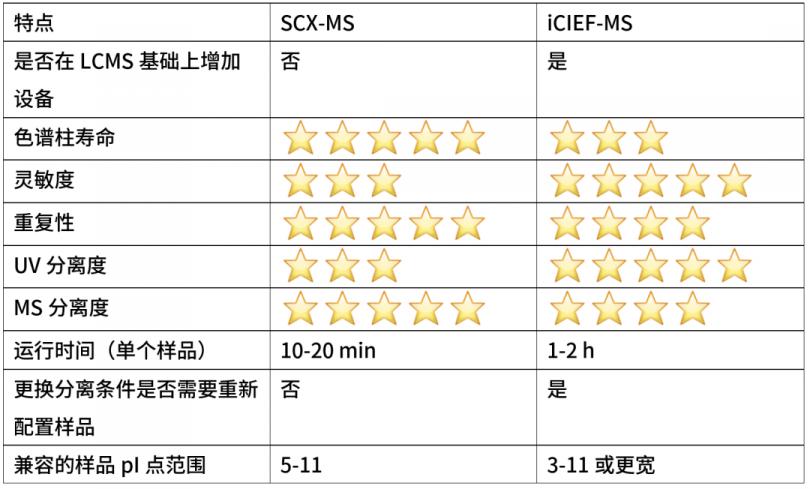
赛默飞的两种电荷异构体技术,SCX-MS和iCIEF-MS均可以实现单抗的电荷异构体分析。两种技术都具有各自的优势,读者可按需选用,也可以两种技术均使用,结果互为印证。
结论
在蛋白电荷异质体的表征中,iCIEF-MS和SCX-MS是两种常见的策略。在本文的研究中,研究人员选取了9种mAb,分别使用iCIEF-MS和SCX-MS进行电荷异质体的表征,并从方法学层面对这两种策略进行了对比。两种方法在蛋白电荷异质体表征方面均能提供可信结果,且互为支持和补充。
相关产品
全部评论(0条)
推荐方案
参与评论
登录后参与评论