发布:
北京易科泰生态技术有限公司时间:
2021-06-28行业:
仪器仪表 仪器仪表
植物荧光活体成像技术及其应用
植物活体成像技术能够在不破坏植物组织的前提下,利用一套非常灵敏的光学检测仪器,直接监控活体植物的细胞活动、光合作用和基因行为。其中应用广泛的荧光活体成像技术,由于操作简单、结果直观、灵敏度高等特点,在植物光合机理、突变体筛选、抗逆基因与表型、生理节律与发育等研究中都有大量的应用。
荧光活体成像技术又可以分为两大类:
一是稳态荧光成像,主要针对GFP等荧光蛋白和DAPI等荧光染料
二是瞬态荧光成像,代表技术为脉冲调制式(Pulse Amplitude Modulated,PAM)叶绿素荧光成像技术,主要用于叶绿素荧光动力学曲线的成像测量,反映植物光合能力、光系统状态、电子传递链运行状况等。
需要注意的是,一般的稳态荧光成像技术也可以测量叶绿素荧光,但只能测量稳定状态下的叶绿素荧光。而叶绿素荧光的动态变化是与光合电子传递状态密切相关的,只有脉冲调制式叶绿素荧光成像技术才能进行叶绿素荧光动力学曲线测量,进而获取大量与植物光合机理相关的参数与成像图。目前国际上仅有FluorCam荧光成像技术将稳态荧光成像技术与脉冲调制式叶绿素荧光成像技术WM融于一体,是真正功能全面的植物荧光活体成像技术,能够在一台仪器上实现GFP、BFP、CFP、YFP、RFP等荧光蛋白成像、DAPI等荧光染料成像、脉冲调制式叶绿素荧光成像以及NDVI反射光谱成像分析功能。同时,除了植物样品外,FluorCam荧光成像技术也可以进行藻类、珊瑚共生体、菌落乃动物的荧光成像分析。
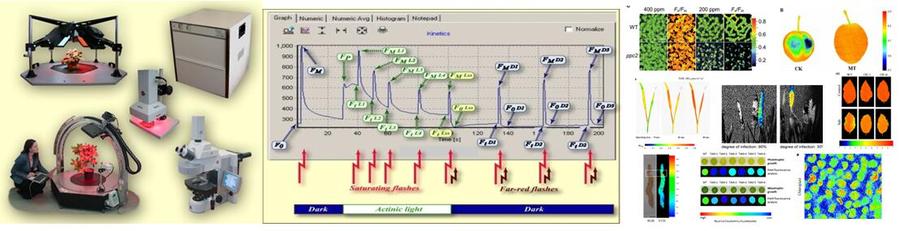
左:各种型号的FluorCam荧光成像系统;中:脉冲调制式叶绿素荧光动力学曲线测量过程;右:各种植物样品的叶绿素荧光成像图

利用FluorCam技术测量的植物样品GFP活体成像图,左:烟草;中:拟南芥;右:感染GFP标记丁香假单胞杆菌的猕猴桃枝条(由易科泰EcoTech实验室提供)
文献案例一:抗病毒基因研究
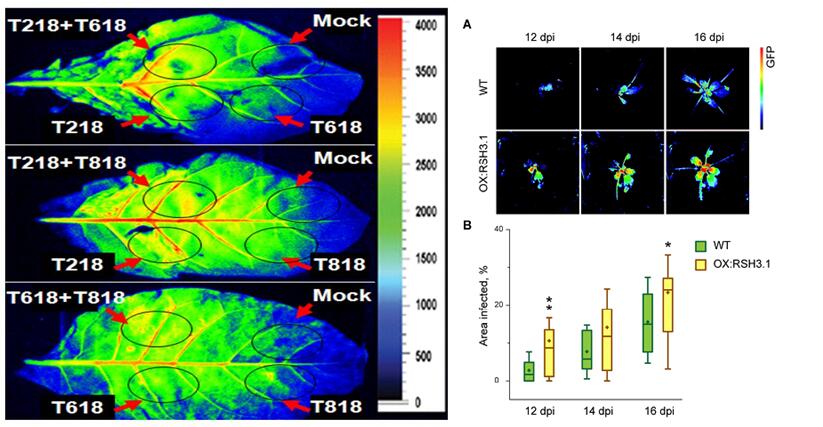
法国农业科学研究院(INRA)的Jean-Luc Gallois研究团队一直致力于马铃薯y病毒组的抗病基因研究。这一病毒组中包括芜菁花叶病毒(TuMV)、西瓜花叶病毒(WMV)、三叶草黄脉病毒(ClYVV)等重要的农作物病毒。这方面研究的难点在于如何直观、定量地测量病毒在植物样品上的分布与积累。FluorCam荧光成像技术的出现解决了这一难题。法国农业科学研究院利用FluorCam封闭式荧光成像系统,从2015年起发表了一系列相关文章,研究方向包括病毒的TOR信号调控、跨物种合成eIF4E1等位基因获得病毒抗性、利用CRISPR-Cas9 base editing基因编辑技术模仿eIF4E自然多态性与病毒抗性的关系、拟南芥敲除eIF4E1获得ClYVV抗性但又与TuMV的敏感性相关等。这些研究中,FluorCam荧光成像技术提供了关键的GFP活体成像图,定量分析感染面积与病毒积累量,从而直观地反映了不同基因功能对拟南芥病毒抗性的影响。同时,叶绿素荧光成像则反映病毒对光合系统的损伤,可以同步提供植物的光合表型信息。

美国田纳西大学、突尼斯El Manar大学、法国艾克斯-马赛大学等科研机构也同样使用FluorCam荧光成像技术的RFP、GFP活体成像功能进行了TuMV、黄单孢菌属等致病菌的调控机理研究。
参考文献:
1.Zafirov D, et al. 2021. When a knockout is an Achilles' heel: Resistance to one potyvirus species triggers hypersusceptibility to another one in Arabidopsis thaliana. Mol Plant Pathol. 22: 334–347
2.Bastet A, et al. 2019. Mimicking natural polymorphism in eIF4E by CRISPR‐Cas9 base editing is associated with resistance to potyviruses. Plant Biotechnology Journal 17: 1736–1750
3.Bastet A, et al. 2018. Trans-species synthetic gene design allows resistance pyramiding and broad-spectrum engineering of virus resistance in plants. Plant Biotechnology Journal: 1–13
4.Ouibrahim L, et al. 2015. Potyviruses differ in their requirement for TOR signaling. Journal of General Virology 96, 2898-2903
5.Liu W. et al. 2014. Synthetic TAL effectors for targeted enhancement of transgene expression in plants. Plant Biotechnology Journal 12, 436–446
6.Abdelkefi H, et al. 2018. Guanosine tetraphosphate modulates salicylic acid signalling and the resistance of Arabidopsis thaliana to Turnip mosaic virus. Molecular Plant Pathology 19(3): 634-646
文献案例二:珊瑚共生体的生态功能研究
珊瑚是腔肠动物珊瑚虫与虫黄藻组成的共生体。葡萄牙阿威罗大学与美国乔治亚大学合作研究珊瑚共生体的叶绿素荧光成像——反映光合能力,NDVI反射光谱指数成像——反映叶绿素的分布及浓度变化,GFPs(绿色荧光蛋白类似蛋白)成像——珊瑚虫本身具备的蛋白,但其意义尚不明确。目前只有FluorCam荧光成像技术可以同步进行这三种成像分析。研究结果不但再次证实了珊瑚本身具备极强的光合作用能力,而且发现叶绿素和GFPs的分布会随着珊瑚虫的膨胀收缩而同步变化,同时两者间表现出显著的分布差异。叶绿素浓度(NDVI)在珊瑚口盘处减少,而GFPs则增加。而叶绿素荧光参数ZD光化学效率Fv/Fm的分布则没有与叶绿素浓度和GFPs的分布表现出相关性。
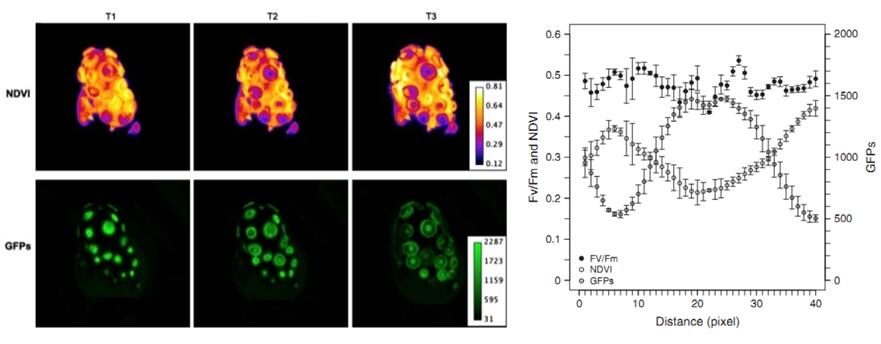
左:钮扣珊瑚收缩-膨胀不同时相NDVI成像与GFPs绿色荧光蛋白成像分析;右; NDVI、GFPs、Fv/Fm的水平剖面变化
参考文献:
Leal MC, et al. 2015. Concurrent imaging of chlorophyll fluorescence, Chlorophyll a content and green fluorescent proteins-like proteins of symbiotic cnidarians. Marine Ecology, DOI: 10.1111/maec.12164
文献案例三:植物内生细菌开发
很多植物内生细菌(plant growth-promoting endophytic bacteria,PGPEB)对植物的生长都具有促进作用,但如何有效利用内生细菌,乃将其开发成一种新型肥料,就必须探索出一整套制剂配方策略。哥伦比亚农业研究公司与德国比勒菲尔德应用科学大学、莱布尼茨蔬菜和观赏作物研究所(IGZ)合作,开发一种植物生长促进内生细菌Kosakonia radicincitans DSM16656的制剂配方策略。这种内生细菌可以通过萝卜根系形成内生后,会显著促进萝卜的生长。为了能够直观检测不同配方处理后细菌在萝卜根系的活力,研究者直接将不同处理后带GFP标记的细菌液滴与萝卜根系放置到FluorCam开放式荧光成像系统中,进行GFP成像成像分析。从GFP荧光强度上即可直接反映不同处理后内生细菌的活性,从而优化ZJ的制剂配方策略。

参考文献:
Barrera MC, et al. 2020. Formulating bacterial endophyte: Pre-conditioning of cells and the encapsulation in amidated pectin beads. Biotechnology Reports 26: e0046
北京易科泰生态技术公司提供植物活体成像研究全面技术方案:
lFluorCam叶绿素荧光及荧光蛋白活体成像系统
lFluorCam多光谱荧光成像系统
lThermo-RGB红外热成像技术
lSpecim高光谱成像测量技术
lPhenoPlot轻便型作物植物表型成像分析系统
lPhenoTron®-HF植物表型与种质成像分析平台
lPlantScreen植物高通量表型成像分析平台