发布:
培安(中国)有限公司时间:
2022-12-29行业:
制药/化妆品 生物制药
摘要
微波增强的多肽固相合成(SPPS)能够快速有效地进行大体积氨基酸(如Aib 和N-Me-A)的常规困难偶联。
酰基载体蛋白衍生物 VQAibAibIDYINGOH 和 VQ(N-Me-A) (N-Me-A)IDYING-OH 的合成在 2 小时内完成,纯度分别为95% 和 86%。
GEQKLGAibAibAibASEESLG-NH2 的合成在 3 小时内完成,纯度为 89%。
介绍
在许多生物学相关的化合物中都可以找到受阻的非标准氨基酸,例如 α-氨基异丁酸 (Aib) 和 N-甲基丙氨酸 ((N-Me)-A)(图 1)。1-3 然而,包括 Aib 或 N-甲基化氨基酸已被证明具有挑战性;第二个甲基引入的空间位阻,无论是在 α-碳还是酰胺氮上,都使得在常规 SPPS 中偶联这些氨基酸衍生物变得困难。
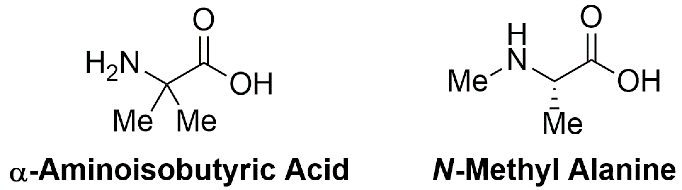
图 1:位阻、非标准氨基酸
然而,通过使用微波增强的SPPS,与受阻非标准氨基酸相关的困难已被Z小化。在 SPPS 中使用微波能量可以快速有效地完成大体积氨基酸(如 Aib 和 N-甲基丙氨酸)的常规困难偶联 4,5。
材料和方法
试剂
N-α-Fmoc-α-氨基异丁酸获自 AnaSpec (Freemont, CA)。 Fmoc-N- Me-Ala-OH 获自 Peptides International (Louisville, KY)。所有其他氨基酸均获自 CEM Corporation (Matthews, NC),并含有以下侧链保护基团:Asn(Trt)、Asp(OMpe)、Gln(Trt)、Glu(OtBu)、Lys(Boc)、Ser( OtBu) 和 Tyr(tBu) 。Oxyma Pure 和 Rink Amide ProTideTM LL 树 脂 购 自CEM Corporation (Matthews, NC)。 N,N-二异丙基碳二亚胺 (DIC) 获 自 CreoSalus (Louisville, KY) 。Fmoc-Gly-Wang Resin LL 购 自NovaBiochem (St. Louis, MO)。哌啶获自 Alfa Aesar (Ward Hill, MA)。三氟乙酸 (TFA)、3,6-dioxa-1,8-octanedithiol (DODT)、三异丙基硅烷 (TIS) 和乙酸购自 Sigma-Aldrich (St. Louis, MO)。二氯甲烷 (DCM)、N,N-二甲基甲酰胺 (DMF) 和无水乙mi (Et2O) 购自 VWR (West Chester, PA) 。HPLC 级 水 (H2O) 和 HPLC 级 乙 腈(MeCN) 购 自 Fisher Scientific (Waltham, MA) 。
多肽合成:GEQKLGAibAibAibASEESLG-NH2
使用CEM Liberty Blue™ 自动微波肽合成仪在Rink Amide ProTide LL 树脂(离子交换容量: 0.18 meq/g)上以 0.1 mmol规模制备多肽。用哌啶和Oxyma Pure 在DMF中进行脱保护。使用DMF中的DIC、DMF中的Oxyma Pure 和5倍过量的Fmoc-AA-OH进行偶联反应。使用具有 TFA/H2O/TIS/DODT 的 CEM Razor 高通量肽切割系统进行切割。裂解后,肽在无水乙mi中沉淀并冻干过夜。
多肽合成: VQAibAibIDYING-OH
使用 CEM Liberty Blue 自动微波肽合成仪在 FmocGly-Wang LL 树脂(离子交换容量:0.33 meq/g)上以 0.1 mmol 规模制备肽。用哌啶和 Oxyma Pure 在 DMF 中进行脱保护。使用DMF 中的 DIC、DMF 中的 Oxyma Pure 和 5 倍过量的 Fmoc- AA-OH 进行偶联反应。使用具有 TFA/H2O/TIS/DODT 的 CEM Razor 高通量肽切割系统进行切割。裂解后,肽在无水乙mi中沉淀并冻干过夜。
多肽合成:VQ(N-Me-A)(N-Me-A)IDYING-OH
使用 CEM Liberty Blue 自动微波肽合成仪在 FmocGly-Wang LL 树脂(离子交换容量:0.19 meq/g)上以 0.1 mmol 规模制备肽。用哌啶和 Oxyma Pure 在 DMF 中进行脱保护。使用DMF 中的 DIC、DMF 中的 Oxyma Pure 和 5 倍过量的 Fmoc- AA-OH 进行偶联反应。使用具有 TFA/H2O/TIS/DODT 的 CEM Razor 高通量肽切割系统进行切割。裂解后,肽在无水乙mi中沉淀并冻干过夜。
多肽分析
在配备有 PDA 检测器的 Waters Acquity UPLC 系统上分析肽,该检测器配备 Acquity UPLC BEH C8 柱(1.7 mm 和 2.1 x 100 mm)。UPLC 系统连接到 Waters 3100 Single Quad MS 用于结构测定。在 Waters MassLynx 软件上进行峰分析。使用 (i) H2O 和 (ii) MeCN 中的 0.1% TFA 梯度洗脱进行分离。
结果
在Liberty Blue 自动微波肽合成仪上GEQKLGAibAibAibAibASEEDLG-NH2的微波增强 SPPS 产生了 89% 纯度的目标肽(图2)。
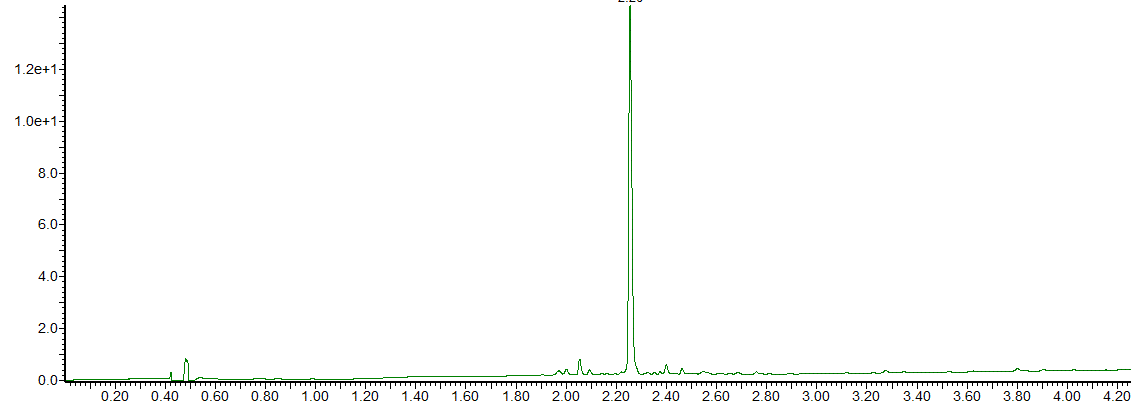
图 2:GEQKLGAibAibAibASEEDLG-NH2的HPLC色谱图
在 Liberty Blue 自动微波肽合成仪上的 VQAibAibIDYING-OH 的微波增强 SPPS 产生了纯度为 95% 的目标肽(图 3)。
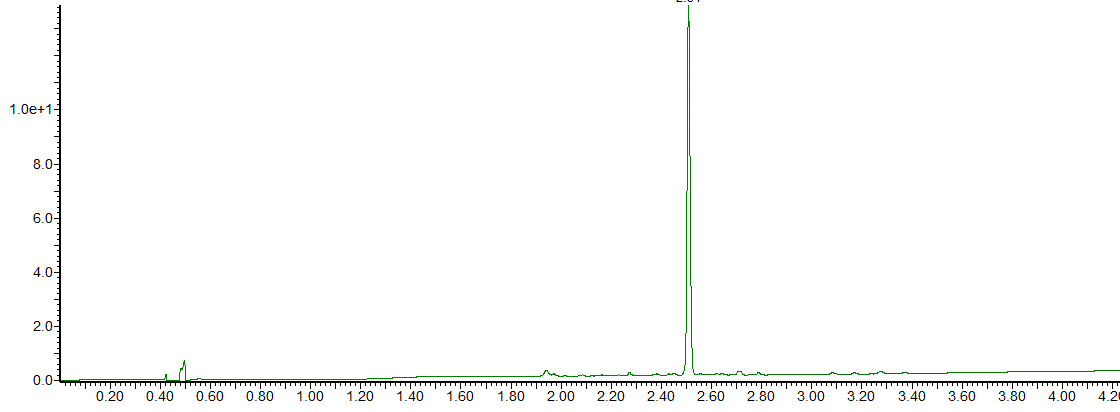
图 3: VQAibAibIDYING-OH的HPLC色谱图
在Liberty Blue 自动微波肽合成仪上的VQ(N-Me-A)(N-Me- A)IDYING-OH 的微波增强 SPPS 产生了纯度为 86% 的目标肽(图 4)。
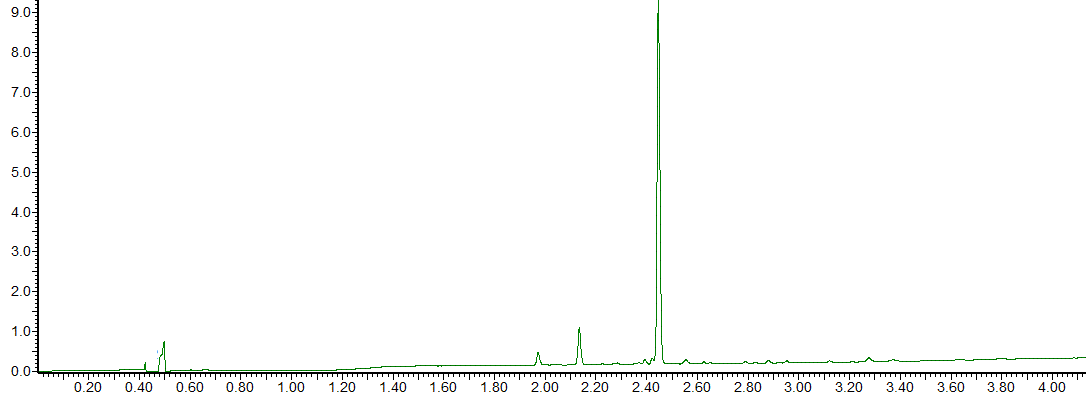
图 4:VQ(N-Me-A)(N-Me-A)IDYING-OH的HPLC色谱图
结论
微波增强的SPPS能够快速有效的进行大体积氨基酸(如Aib和N-Me-A)的常规困难偶联。常规合成GEQKLGAibAibAibASEEDLG-NH2 需要40小时且纯度 < 10%,但微波增强 SPPS 在 3 小时内产生目标肽且纯度为 89%。 此外,酰基载体蛋白衍生物VQAibAibIDYING-OH 和 VQ(N-Me-A)(N-Me-A)IDYING-OH 的合成在 2 小时内完成,纯度分别为 95% 和 86%。 微波增强的 SPPS 已被证明是一种有效的工具,可以Zda限度地减少SPPS中受阻的非标准氨基酸相关的困难。
参考文献
[1] Mueller, P.; Rudin, D. O. Nature. 1968, 217, 713–719.
[2] Rebuffat, S.; Goulard, C.; Hlimi, S.; Bodo, B. J. Pept. Sci. 2000, 6, 519–533.
[3] Ahmed, G.; Elger, W.; Meece, F.; Nair, H. B.; Schneider, B.; Wyrwa, R.; Nickisch, K. Bioorg. Med. Chem. 2017, 25, 5569–5575. Collins, J. M. Microwave-Enhanced Synthesis of Peptides, Proteins, and Peptidomimetics. In Microwaves in Organic Synthesis, Third Edition; de la Hoz, A.; Loupy, A.; Wiley-VCH: Weinheim, 2012; 897–959.
[4] Ben Haj Salah, K.; Inguimbert, N. Org. Lett. 2014, 16 (6), 1783–1785.