
立即扫码咨询
联系方式:400-168-5267
联系我们时请说明在仪器网(www.yiqi.com)上看到的!

背 景 介 绍
MDSCs可分为单核型和粒细胞型MDSCs (M-MDSCs和PMN-MDSCs)。固有免疫方面,MDSCs可以抑 制NK细胞功能;诱导 Treg扩增,促进Treg对免疫的负调控作用;在适应性免疫方面MDSCs可以抑 制T细胞免疫应答。

MDSCs通过一系列细胞因子与其他免疫细胞相互作用,多种机制共同作用对免疫细胞进行调节。MDSCs是树突状细胞(dendritic cells,DCs)、巨噬细胞和(或)粒细胞的前体,在癌症、慢性感染、自身免疫病和移植的发病机理中起关键作用。以往的研究多聚焦在肿瘤方向。
今天要给大家介绍的一篇文章是第 一个研究MDSCs在脓毒症中的积极作用的。由于脓毒症患者表现出炎症和免疫抑 制的迹象,因此 MDSCs 可能通过抑 制某些患者的有害炎症来提供益处。为了验证这一假设,此研究测试了患有肺炎和多器官功能障碍且死亡可能性很高的重症脓毒症患者的 MDSCs。
实验方案
此文中的实验为一种靶向流式细胞术方法,使用DURAClone(Beckman Coulter)的靶向MDSCs的冻干荧光标记抗体混合物的试管。
DURAClone方案的优势:
减少样本处理/标记和分析导致的可变性,增加不同研究中心实验结果的标准化和可比性。
预混合干粉试管,提高实验效率。
DURAClone(Beckman Coulter) MDSCs流式方案

M-MDSCs表型为:CD11b+ CD14+ CD15-/low CD16- CD33+ HLA-DR-/low 。
PMN-MDSCs 表型为:CD11b+ CD14- CD15+ CD16+ CD33 low HLA-DR- 。
分析策略:
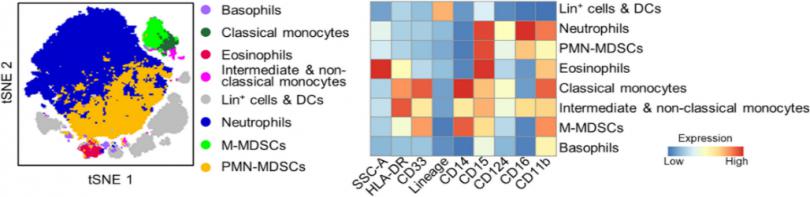
排除双连体细胞和非造血(CD45阴性)细胞,降维聚类分析。(下图)

结果表达:
根据生物学知识和标记表达合并为8个细胞亚群,如 tSNE和热图,白细胞群的t-SNE图(左)和侧向散射区(SSC-A)以及表面标志物的表达水平(右)。Lin+:谱系(即CD3,CD19,CD56)阳性;DC:树突状细胞
结 论
1、脓毒症患者M-MDSCs和PMN-MDSCs表达情况:
与健康受试者相比,脓毒症患者中M-MDSCs和PMN-MDSCs都是增加的。但PMN-MDSCs增加与继发性感染(p=0.024)和新的败血症发作(p=0.036)相关(图2A)。
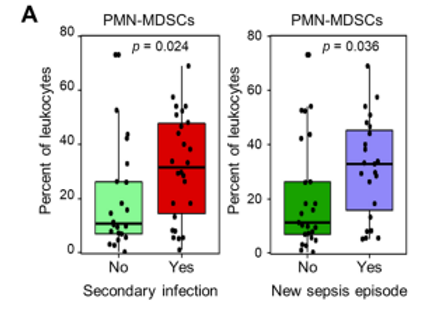
图2A :PMN-MDSCs与继发性感染和新的脓毒症发作的关系。
2、PMN-MDSCs:
幸存者和早期和晚期死亡(即≤28天和>28天)表达了相似水平的PMN-MDSCs(图3B)。
M-MDSCs:相比之下,幸存者表达的M-MDSCs是早期死亡的1.64倍(4.6% [2.6-6.7] vs 2.8% [1.5-3.6],p=0.028),尽管不显著,但M-MDSCs是晚期死亡的1.55 倍 MDSCs (3.0% [2.3–4.7], p=0.19) (图3B)。
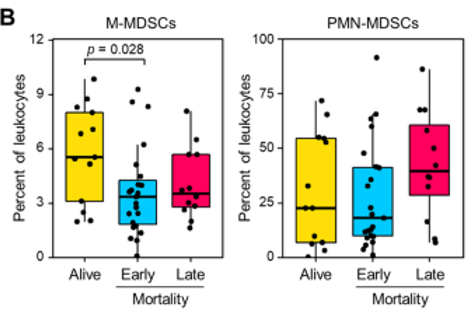
图3B:存活者(n = 14)、早期死亡(<28天,n = 23)和晚期死亡(> 28天,n = 12)中的M-MDSCs和PMN-MDCs。箱线图显示中位数、上位数和下位数。胡须显示5到95个百分点。每个点代表一个单独的样本
3、将高M-MDSC水平与 (APACHE,低值的急性生理和慢性健康评估) II评分相结合可以改善患者分层(M-MDSCshigh/APACHE IIlowvs M-MDSCslow/APACHE IIlow: 90天死亡率为20% vs 80%)。(黄色VS绿色)
4、高水平 M-MDSCs 患者的 90 天死亡率降低(高vs低 MDSCs:47% vs 84% 死亡率,(图 4A),在多变量分析中,高M-MDSCs与低APACHE II评分患者的生存改善相关。
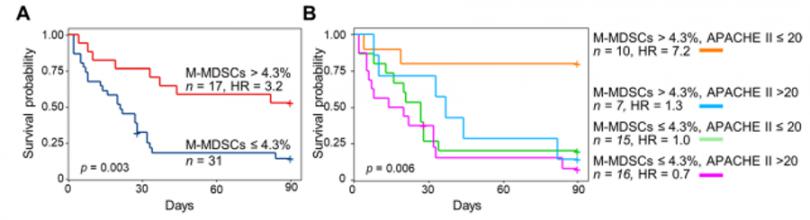
图4 :M-MDSCs水平高低(<4.3%,白细胞>4.3%)(A), MDSCs水平高低与APACHE II评分高低(<20,> 20)相结合(B)的Kaplan-Meier 90天生存曲线。采用log-rank检验进行统计学差异评估;纵坐标:存活率
5、研究表明M-MDSCs与伴有多器官衰竭的肺炎和败血症患者的良好预后相关。这些观察结果为进一步研究MDSCs 在严重脓毒症和多器官衰竭患者中的作用提供了动力,并有助于破译调节细菌性脓毒症中 MDSCs 扩增和激活的机制。
文章亮点
1、迄今为止的实验调查和所有临床研究表明,MDSCs在脓毒症期间是有害的 [2]。入院时高水平的 MDSCs与手术感染性休克患者的早期死亡率相关,而在第 6-8 天高水平的 M-MDSCs 与感染性休克患者的死亡率和继发性感染相关。
2、有趣的是,文章提出MDSCs 在脓毒症中发挥着双重作用。虽然是假设性的,但这个假设是建立在几个事实之上的。首先,MDSCs 是吞噬细胞,它可以通过摄入和杀死微生物来帮助对抗感染。其次,MDSCs 可以抑 制由病原体分子模式或内源性起源引起的全身或局部炎症,后者在压力或组织损伤期间释放。
讨 论
有几个因素可以解释文献中报道的差异,例如病原体和感染部位、影响骨 髓生成和 MDSCs 生成的炎症状态、采血和下游治 疗的时间,或MDSC的免疫表型分析 [3]。我们总结一下文章中提到的在流式实验中样品选择对结果影响的几个因素:
1、在全血中比在 PBMC 中更容易检测到 MDSCs [4]。早期对MDSCs研究的一个缺陷是缺乏对样品处理的协调,Z 终缺乏对 MDSC 亚群的区分。
2、PMN-MDSCs 而不是 M-MDSCs 对 PBMCs 的冷冻/解冻敏感,而 M-MDSCs 比 PMN-MDSCs 对延迟血液处理更敏感 [5,6]。
结 论
本文实验中为了尽量减少分析变化,使用贝克曼 DURAClone管抽取后立即标记全血,用实例证明贝克曼DURAClone干粉试剂不仅有利于结果标准化和可比性,还使您的实验操作变的更简单。
另外,精简后用单抗搭配的MDSCs方案:
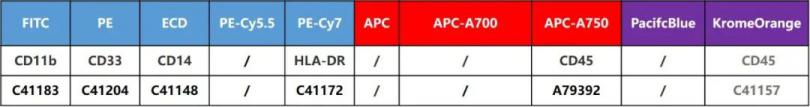
注:可根据仪器通道选择相应的CD45
M-MDSCs表型为:CD11b + CD33 + CD14 + HLA-DR-/low 。
PMN-MDSCs表型为:CD11b + CD33 low CD14 - HLA-DR- 。
文献出处
[1]Schrijver, I.T., Karakike, E., Théroude, C. et al. High levels of monocytic myeloid-derived suppressor cells are associated with favorable outcome in patients with pneumonia and sepsis with multi-organ failure. ICMx 10, 5 (2022). https://doi.org/10.1186/s40635-022-00431-0
[2] Venet F, Monneret G (2018) Advances in the understanding and treatment of sepsis-induced immunosuppression. Nat Rev Nephrol 14:121–137.
[3] Gabrilovich DI (2014) Editorial: The intricacy of choice: can bacteria decide what type of myeloid cells to stimulate? J Leukoc Biol 96:671–674.
[4] Apodaca MC, Wright AE, Riggins AM et al (2019) Characterization of a whole blood assay for quantifying myeloidderived suppressor cells. J Immunother Cancer 7:230.
[5] Grutzner E, Stirner R, Arenz L et al (2016) Kinetics of human myeloid-derived suppressor cells after blood draw. J Transl Med 14:2. https://doi.org/10.1186/s12967-015-0755-y 51.
[6] Kotsakis A, Harasymczuk M, Schilling B et al (2012) Myeloid-derived suppressor cell measurements in fresh and cryopreserved blood samples. J Immunol Methods 381:14–22.
[7] Isabel Poschke , Rolf Kiessling, On the armament and appearances of human myeloid-derived suppressor cells, Clin Immunol 2012 Sep;144(3):250-68.
相关产品
全部评论(0条)
推荐方案
参与评论
登录后参与评论