
立即扫码咨询
联系方式:400-855-8699转8059
联系我们时请说明在仪器网(www.yiqi.com)上看到的!

目前,分析淋巴细胞介导的抗肿瘤细胞毒性的标准测定法是采用放射性同位素或荧光标记等终点分析法。然而,这样的测定很难实现实时的分析。来自日本的科学家近日在STAR PROTOCOL发表了一种实验方案:“A protocol for quantifying lymphocytemediated cytotoxicity using an impedance based real-time cell analyzer”,该方案使用无需标记、基于阻抗的实时细胞分析仪xCELLigence real-time cell analyzer (RTCA) 分析淋巴细胞介导的毒性。
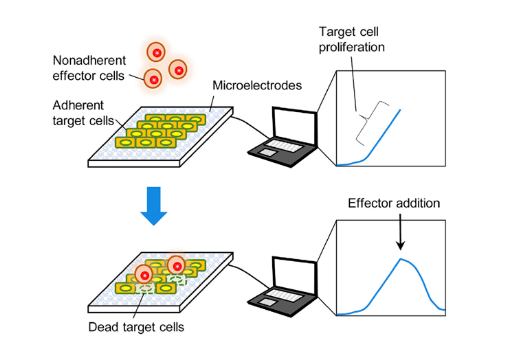
xCELLigence RTCA系统无创伤且实时连续地测量细胞电阻抗,并通过软件计算Z 终以细胞指数值展示结果。同时生成实时杀伤曲线,可用于实时量化淋巴细胞介导的细胞毒性。
实验原理
xCELLigence RTCA的专用耗材E-Plates每个孔底部均嵌有阵列排布的微金电极生物传感器。当靶细胞黏附到板底时会产生电阻抗, 每个孔的电阻抗被报告为细胞指数,它连续且无创地表示细胞数量的变化。如果悬浮的效应细胞(CAR-T, CAR-NK, Lymphocyte等)杀伤贴壁靶细胞,则检测到相应的杀伤活性。每孔数据的连续采集同时生成多种条件下的实时杀伤曲线。
实验步骤
STEP01:效应细胞的诱导
1、按照1 x106 B16-F1细胞/mouse接种到两只8w 的WT C57BL/6J小鼠,肿瘤平均直径在两周后可达到6mm;
2、Day-2:铺板的B16-F1细胞融合率达到30%-50%时将培养基换成含有100U/ml IFN-γ的DMEM,然后继续培养48h;
3、Day0: 接种两周后收集小鼠脾 脏单个细胞,并按照40 x106脾 脏细胞与2 x106 B16-F1细胞(100U/ml IFN-γ预处理两天)共培养5天。
STEP02:靶细胞的接种
1、Day2:铺板的B16-F1细胞融合率达到30%-50%时将培养基换成含有100U/ml IFN-γ的DMEM,然后继续培养48h;
2、Day4:37℃预热培养基30min,打开仪器和软件,并根据实验要求设置软件步骤,将50µl 培养基加入到RTCA E-plate中放到RTCA中并进行背景读数。然后将处理好的B16-F1细胞按照0.5-2 x104 cells/100 µl加入到E-plate中。将板子15-25℃放置30min使细胞沉降到底部。然后将板子放在置于培养箱的RTCA仪器中进行实时监测18–36 h,且设置每15min进行一次电阻读取。
STEP03:效应细胞的添加
1、Day5:将诱导的脾 脏细胞作为效应细胞按照不同的效靶比(Effector:Target ratios = 12.5:1, 25:1, and 50:1)加入到E-plate的靶细胞中,将板子15-25℃放置30min使细胞沉降到底部。然后将板子放回RTCA仪器继续进行实时监测,且设置每15min进行一次电阻读取(500 sweeps, 125 h)。
STEP04:效应细胞的添加
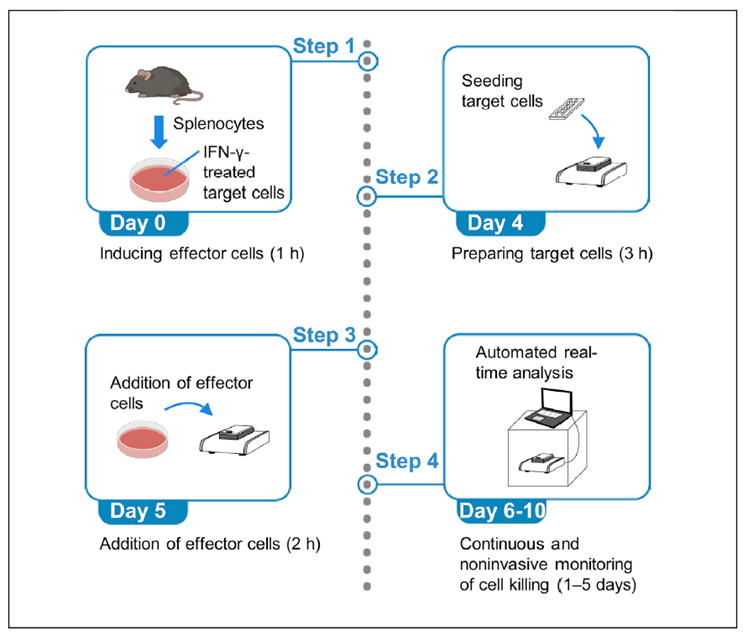
图2.实验流程图
结果与讨论
接种不同数量的B16-F1细胞(0.5x104, 1 x104,2 x104,4 x104cells/孔),根据细胞指数增长反应细胞的增殖情况(图3.A),同时通过RTCA软件统计0-70h内的斜率来反应细胞指数的变化率(图3.B)。根据不同接种数量细胞的增殖曲线结果可以选择合适的靶细胞接种量。
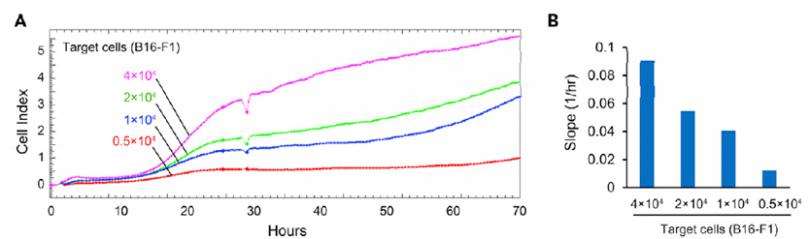
图3. 使用 xCELLigence RTCA分析靶细胞的增殖
应用RTCA的杀伤试验操作简单,只需将2 x104个靶细胞(B16-F1)接种到每个孔中,靶细胞生长到平台期大概28h时,按照不同效靶比(E:T,lymphocytes:B16-F1 细胞)加入效应细胞:100 x104,50 x104,25 x104 cells/孔(图4.A),效应细胞对靶细胞的杀伤作用会导致细胞指数曲线的变化,且杀伤作用呈剂量依赖。同时RTCA软件可输出实时细胞杀伤数据的分析(图4.B)。
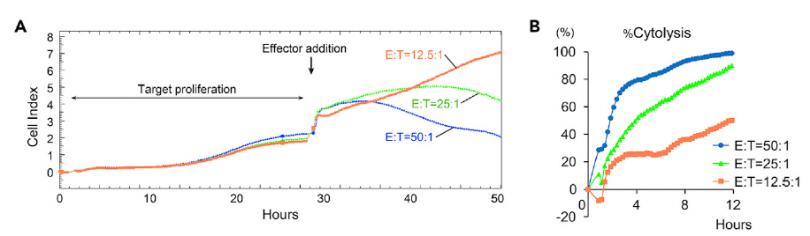
图4. 使用 xCELLigence RTCA分析效应细胞的杀伤
本文为大家介绍了一种应用xCELLigence RTCA系统来评估效应细胞杀伤的实验方案,整体实验流程简单,操作简便。同时作者在文中也提到不局限于效应细胞的类型,当然也不局限靶细胞类型的杀伤实验应用。因此xCELLigence RTCA也可以应用到T细胞或者NK细胞等对肿瘤细胞的的杀伤评估,助力肿瘤研究。
相关产品
全部评论(0条)
推荐方案
相关解决方案
参与评论
登录后参与评论