发布:
培安(中国)有限公司时间:
2022-08-30行业:
生物产业 综合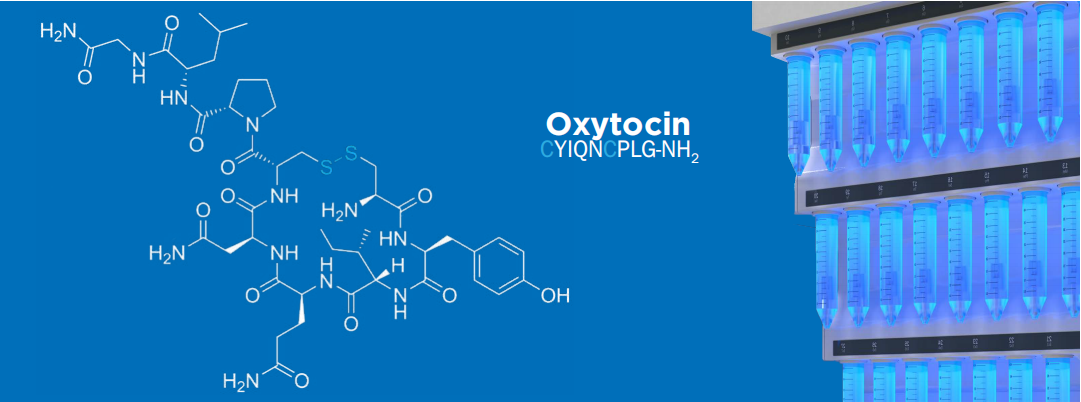
使用微波增强的多肽固相合成(SPPS)可以快速制备具有良好纯度的环状二硫键多肽(Cyclic disulfide-bridged peptides)。肽激素催产素(Oxytocin)1的合成在3小时内完成,纯度为69%。BMP受体激活素样激酶3(BMP receptor activin-like kinase 3,Alk3) 肽激动剂THR-1232的制备在3小时内完成,纯度为77%。CHEC-73是一种淀粉样蛋白生成的神经保护肽yi制剂,可在3小时内制备,纯度为80%。zui后,在4小时内合成了一种来自锥螺的肽毒素(conotoxin-SI)4,其含有两个二硫键,纯度67%。
简介
含有二硫键的环状肽是一类具有广泛生物学功能的化合物,包括从毒液到不可或缺的激素5。二硫键有助于稳定肽的二级结构和构象,提高蛋白水解稳定性和靶标亲和力6。因为其具有广阔的治liao潜力,人们对合成环状二硫键桥肽的兴趣稳步增长。
通过使用正交保护的半胱氨酸氨基酸,例如Fmoc-(S)-Cys(Mmt)- OH和Fmoc-(S)-Cys(STmp)-OH,SPPS可以制备具有二硫键的肽(图1)。Cys(Mmt)基团可以使用三氟乙酸(TFA)的稀溶液选择性脱保护,而Cys(STmp) 基团使用二硫苏糖醇(DTT)作为还原剂进行正交脱保护。去保护后,可以使用N-氯代琥珀酰亚胺(NCS)作为温和氧化剂,选择性氧化半胱氨酸硫醇基团以形成二硫键7。将微波能量应用于二硫桥肽的合成可以实现更有效的偶联,从而节约合成时间和提高纯度(CarboMAXTM)8。
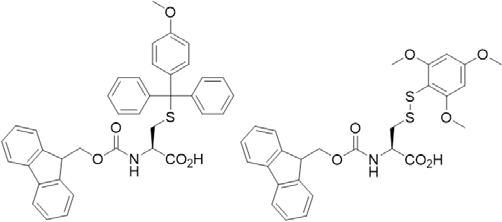
图1 左:Fmoc-(S)-Cys(Mmt)-OH;
右:Fmoc-(S)-Cys(STmp)-OH
材料和方法
试剂
以下含有指定的侧链保护基团Fmoc氨基酸购自CEM Corporation (Matthews, NC) :Ala、Arg (Pbf)、Asn (Trt)、Asp (OMpe)、Gln (Trt)、Gly、Ile、Leu、Lys (Boc)、Phe、Pro、Ser (tBu)、Tyr(tBu) 和Val。Rink Amide ProTideTM LL树 脂 和Cl-MPA ProTideTM LL树脂也购自CEM Corporation。Fmoc-(S)-Cys(Mmt)-OH和Fmoc-(S)-Cys(STmp)-OH购自EMD Millipore(Burlington,MA)。N-氯代琥珀酰亚胺(NCS)、DL-二硫苏糖醇(DTT)、4-甲基吗啉(NMM)、N,N'-二异丙基碳二亚胺(DIC)、哌啶、哌嗪、三氟乙酸(TFA)和三异丙基硅烷(TIS)购自Sigma-Aldrich(St. Louis,MO)。二氯甲烷(DCM)、N,N-二甲基甲酰胺(DMF)、1-甲基-2- 吡咯烷酮(NMP)、乙醇、无水乙mi(Et2O)、乙酸、HPLC级水和乙腈购自VWR(West Chester,宾夕法尼亚州)。LC-MS 级水(H2O)和LC-MS 级乙腈(MeCN)购自Fisher Scientific(Waltham, MA)。多肽合成:催产素(Oxytocin), CYIQNCPLG-NH2
使用CEM Liberty Blue™自动微波肽合成仪在0.526g Rink Amide ProTide LL树脂(离子交换容量:0.19 meq/g )上以0.10mmol规模合成多肽(图2),以0.05mmol规模进行二硫化物形成。用20%哌啶和0.1M Oxyma Pure的DMF溶液进行脱保护。偶联反应在5倍过量的0.2M Fmoc-AA与1.0M DIC和1.0M Oxyma Pure的DMF中进行(CarboMAX)8。Fmoc-(S)- Cys(Mmt)OH用作C端氨基酸。2%TFA的DCM溶液用于去保护Cys(Mmt)基团。使用25mM NCS在DMF中的溶液形成二硫化物。使用具有95:2.5:2.5 TFA/H2O/TIS的CEM Razor™高通量肽切割系统进行切割。裂解后,用无水乙mi沉淀肽并冻干过夜。

图2:催产素
多肽合成: THR-123, CYFDDSSNVLCKKYRS-CO2H
使用CEM Liberty Blue自动微波肽合成仪在0.556g Cl-MPA ProTide LL树脂(离子交换容量:0.18 meq/g)上以0.10mmol规模合成肽(图3)(以0.05mmol规模进行二硫化物形成)。用20%哌啶和0.1M Oxyma Pure的DMF溶液进行脱保护。偶联反应在5倍过量的0.2M Fmoc-AA 1.0M DIC和1.0M Oxyma Pure在DMF(CarboMAX)中进行。8Fmoc-(S)-Cys(Mmt)-OH用于半胱氨酸C。A溶液DCM中2%TFA用于去保护Cys(Mmt)。使用25mM NCS在DMF中的溶液形成二硫化物。使用具有95:2.5:2.5 TFA/H2O/TIS 的CEM Razor高通量肽切割系统进行切割。裂解后,用无水乙mi沉淀肽并冻干过夜。
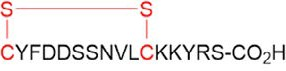
图3:THR-123
多肽合成 :CHEC-7, CHEAAQC-CO2H
使用CEM Liberty Blue自动微波肽合成仪在0.556g Cl-MPA ProTide LL树脂(离子交换容量:0.18 meq/g)上以0.10mmol规模合成肽(图4),以0.05 mmol规模进行二硫化物形成。用10%哌嗪在1:9乙醇/NMP 中的溶液进行脱保护。偶联反应在5倍过量的0.2M Fmoc-AA与1.0M DIC和1.0M Oxyma Pure在DMF中进行(CarboMAX)8。Fmoc-(S)-Cys(Mmt)-OH用于半胱氨酸C。溶液DCM中2%TFA用于去保护Cys(Mmt)基团。使用25mM NCS在DMF中的溶液形成二硫化物。使用具有95:2.5:2.5 TFA/H2O/TIS的CEM Razor高通量肽切割系统进行切割。裂解后,用无水乙mi沉淀肽并冻干过夜。
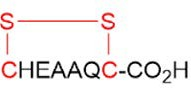
图4:CHEC-7
多肽合成:Conotoxin-SI, ICCNPACGPKYSC-NH2
使用CEM Liberty Blue自动微波肽合成仪在0.526g Rink Amide ProTide LL树脂(离子交换容量:0.19 meq/g)上以0.10mmol规模合成肽(图5)(以0.05mmol规模进行二硫化物形成)。用20%哌啶和0.1M Oxyma Pure的DMF溶液进行脱保护。偶联反应在5倍过量的0.2M Fmoc-AA与1.0M DIC和1.0M Oxyma Pure的DMF(CarboMAX)8中进行。Fmoc-(S)Cys(Mmt)-OH用于C,Fmoc-(S)-Cys(STmp)-OH用于半胱氨酸C。5% DTT和0.1M的NMM的DMF溶液用于去保护Cys(STmp)基团。使用25mM NCS在DMF中的溶液形成第一个二硫化物。2% TFA在DCM中的溶液用于去保护Cys(Mmt)。使用相同的NCS在DMF中的溶液形成第二个二硫键。使用具有95:2.5:2.5 TFA/H2O/TIS的CEM Razor高通量肽切割系统进行切割。裂解后,用无水乙mi沉淀肽并冻干过夜。
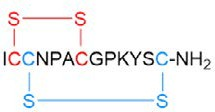
图5:Conotoxin-SI
多肽分析
在配备有PDA检测器的Waters Acquity UPLC系统上分析肽,该检测器配备Acquity UPLC BEH C8柱(1.7mm和2.1x100mm)。UPLC系统连接到Waters 3100 Single Quad MS用于结构测定。在Waters MassLynx软件上进行峰分析。使用0.05% TFA的(i)H2O和(ii)MeCN溶液梯度洗脱进行分离。
结果
Liberty Blue自动微波肽合成仪上使用微波增强SPPS产合成催产素,产生了纯度为69%的目标肽(图6)。
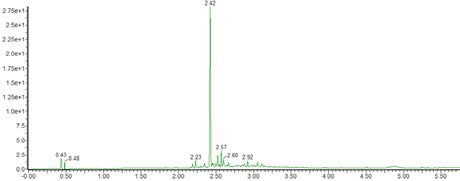
图6:催产素的UPLC色谱图
在Liberty Blue自动微波肽合成仪上使用微波增强SPPS合成THR-123,产生了纯度为77%的目标肽(图7)。
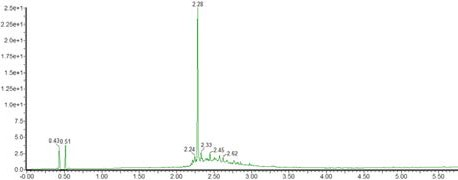
图7:THR-123的UPLC 色谱图
在Liberty Blue自动微波肽合成仪上使用微波增强SPPS合成CHEC-7,产生了80%纯度的目标肽(图8)。注意:5.72 min(参见图9)和5.85min(参见图10)处的峰均具有目标肽质量,不是差向异构化的结果。
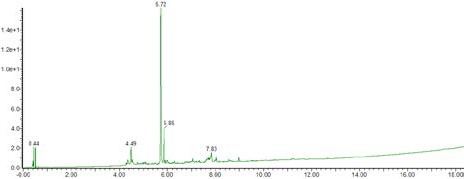
图8:CHEC-7 的UPLC色谱图
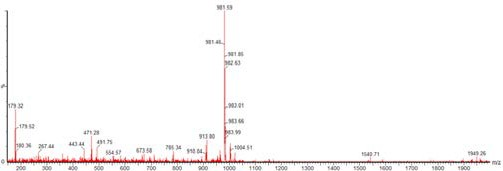
图9:保留时间为5.72分钟的峰质谱图
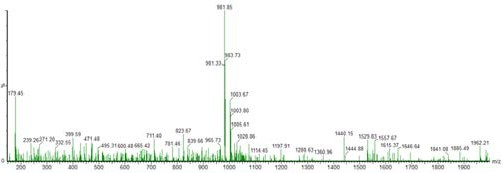
图10:保留时间为5.85 分钟的峰质谱图
Liberty Blue自动微波肽合成仪上使用微波增强SPPS合成芋螺毒素-SI,产生了纯度为67%的目标肽(图11)。
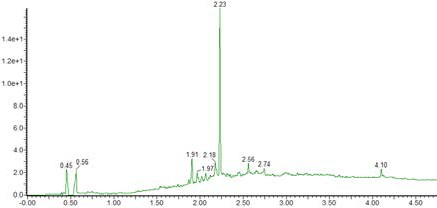
图11 :Conotoxin-SI 的UPLC色谱图
结论
使用自动微波增强多肽固相合成(SPPS)可以快速有效地合成二硫键桥接环肽。催产素的常规室温合成需要超过13小时才能生成二硫键桥接肽7。使用微波增强SPPS,该肽在3小时内合成,纯度为69%。在3小时内以高纯度(分别为77%和80%产率)快速合成了具有C末端酸的环状二硫键桥肽THR-123和CHEC-7。含有两个二硫键的芋螺毒素-SI的常规室温合成需要20小时7。另一方面,微波增强的SPPS可在4小时内提供纯度为67%的肽。
参考文献
[1]Lee, H.-J.; Macbeth, A. H.; Pagani, J. H.; Young, W. S.; 3rd. Prog. Neurobiol. 2009, 88 (2), 127–151.
[2]Sugimoto, H.; LeBleu, V. S.; Bosukonda, D.; Keck, P.; Taduri, G.; Bechtel, W.; Okada, H.; Carlson, W.; Bey, P.; Rusckowski, M.; Tampe, B.; Tampe, D.; Kanasaki, K.; Zeisberg, M.; Kalluri, R.; Kalluri, R. Nat. Med. 2012, 18 (3), 396–404.
[3]Cunningham, T. J.; Greenstein, J.; Yao, L.; Fischer, I.; Connors, T. Rejuvenation Res. 2018, rej.2017.2049. [4]Azam, L.; McIntosh, J. M. Acta Pharmacol. Sin. 2009, 30 (6), 771–783.
[5]Góngora-Benítez, M.; Tulla-Puche, J.; Albericio, F. Chem. Rev. 2014, 114 (2), 901–926.
[6]Adessi, C.; Soto, C. Curr. Med. Chem. 2002, 9 (9), 963–978.
[7]Postma, T. M.; Albericio, F. Org. Lett. 2013, 15 (3), 616–619.
[8]CEM Application Note (AP0124) - “CarboMAX - Enhanced Peptide Coupling at Elevated Temperature”.
[9]CEM Technical Note (P/N: 600837) - “Cl-MPA ProTide and Cl-TCP(Cl) ProTide Resin Loading and Protected Cleavage Procedures”.