
立即扫码咨询
联系方式:400 820 3586
联系我们时请说明在仪器网(www.yiqi.com)上看到的!
导言
血管生成是由预先存在的血管所形成和重塑的新血管及毛细血管的生理过程。这可以通过血管和毛细血管的内皮细胞出芽或分裂来实现。血管细胞通过降解细胞外基质对适当的刺激做出反应,随后诱导内皮细胞增殖和迁移 1,2。
细胞经历过这些过程后,形成一个包含腔的管,一个动态的空间,促进血液流动和氧、二氧化碳、一氧化氮和营养物质的交换。血管生成是生长发育、伤口愈合和肉芽组织形成的重要过程。血管生成生长也会支持肿瘤细胞在健康组织中的侵袭,在癌症研究中通常被量化监测。当血管芽向血管生成刺激源延伸时,内皮细胞利用黏附分子进行纵向迁移。这些芽随后形成环状,利用迁移至此的细胞形成一个完整的血管腔。出芽过程在体内以每天几毫米的速度进行着,并使新的血管能够跨越间隙生长。许多抗血管生成药物已被开发于癌症治疗,而促血管生成分子则可能在再生应用中具有潜力。迄今为止的体外实验仅模拟了血管生成机制的某些方面,包括划痕实验、博伊登室和管形成实验。
主要特点
• 可视化血管生成出芽和三维重构
• 对血管生成进行定量评估,包括芽的数量、总体积和平均荧光强度
• 使用 OrganoPlate 芯片板获得与生理相关的数据
MIMETAS 的科学家开发了先进的、更具生理相关性的模型,其中包括在促 / 抑制 - 血管生成因子条件下,包埋进细胞外胶质基中主血管的实际生长和出芽。这些诱因既可以通过灌注泳道加入,也可以通过一个共培养装置由组织直接分泌出来。
高内涵成像可以进行可视化血管生长结构、三维重构,并能进行血管生成和新血管萌发相关的复杂分析。在这里,我们描述了一种可获得血管生成相关的多维量化结果的成像分析方法,以用于疾病表型和复合效应的比较研究。
方法
细胞模型
3D 血管生成模型是在 MIMETAS OrganoPlate 3-lane3,4细胞芯片板上构建而成。OrganoPlate 3-lane 板是基于 384 孔板上设计而成的,每个微流控单元由 3x3 个孔组合而成,整板共 40 个单元 ( 图 1 )。每一个微流控单元包含了三个泳道。胶原 -I 细胞外基质 (ECM) 胶被填埋入中间的泳道内。被称为“ 相导 ”(phaseguides) 的小型压力屏障将 ECM 凝胶定型,防止其流入邻近的灌注泳道。接着,将内皮细胞 ( 原代细胞系,iPSC 诱导 ) 种到灌注泳道上方,并附着于 ECM 胶上。灌注开始时将OrganoPlate 放置在摇床上,当细胞增殖时,它们形成内皮微血管。在血管形成后,在母体内皮血管的另一侧的底部灌注泳道中加入一系列促血管生成因子。由此产生的血管生成的化合物梯度会诱导血管生成芽。血管新生芽培养 0-4 天,然后固定,并进行定量分析比对。可以在附录中找到三维血管生成模型的示意图。
成像
血管细 胞 和芽用 4% 甲醛固定,用抗 VE-cadherin 的一抗结合样本,再用二抗 Alexa488 ( 绿色 ) 进行染色标记。肌动蛋白丝用 ActinRed ™ ReadyProbes ™试剂( 红色 ) 染色,细胞核用 Hoechst ( 蓝色 ) 染色。细胞用ImageXpress Micro 共聚焦高内涵成像系统 (Molecular Devices) 进行成像。细胞图像使用共聚焦模式 ( 60 µmpinhole 转盘 ),在 10x 或 20x 水镜下进行成像。20x 成像中,采 集了45-58 层的 z-stack 图层图像,每层 2-4µm 间距。对于 10x 物镜,采集了 15-25 层图层,每层4-6 µm 间距。细胞核用 DAPI 通道,血管生成的芽用FITC 通道,分别在 100 ms 和 400 ms 曝光时间下采集图像。
图像分析
图像分析使用了 MetaXpress 高内涵成像分析软件中的 Custom Module Editor 客制化分析功能。细节在结果部分 做了详细描述。简单来说,使 用了 Neurite Outgrowth 模块对延伸的血管芽进行识别,使用 Count Nuclei 模块进行细胞核表征。然后用“ Z佳匹配连接 ”功能将物体在三维空间的 z 平面之间进行连接。二次分析则是在 Excel 软件中完成的。使用 MetaXpress 软件中的 3D 自定义模块分析图像。分析方法的展示需要用到 Custom Module Editor (CME) 和
3D 图像分析能力。自定义模块包含了几个步骤,首先用Neurite Outgrowth 模块识别出每张图中的血管芽,处于 3D 空间中不同 Z 层面的物体利用“ Z佳匹配连接 ”选项进行三维拼接。随后血管芽的数量,以及它们的体积和荧光强度值都能在分析中获得。细胞核的计数是可选项,无论是每张图的总细胞核数量,还是每个芽的细胞核数量都可以被定量。在分析过程中使用的感兴趣区域图层只包括位于凝胶泳道内的物体,而不包括内皮细胞管通道内的物体。用这种方法可以只计算血管生成芽,而不计算上泳道的细胞。所开发出的自定义分析模块在20x 和 10x 图像中都可以应用。或者,图像分析也可以在2D Z大值投影图像上进行分析。对于芽的长度评价,略有不同的是,在 CME 中使用“Fibers”应用模块来进行分析 ( 未显示 )。

结果
时间依赖的血管生成过程模型在 OrganoPlate 3-lane 中进行建模。血管内皮细胞被种于上泳道中,三天左右形成血管。该模型包括内皮细胞在上层泳道或同时在上层和底层泳道中生成的血管,或者在中间的胶原蛋白胶质层 ( 图 1 )。底部泳道添加生长因子可以促进在胶原蛋白中生成血管新生芽,并能进行成像和分析 ( 图 2 )。
如图二所示,图像以 10x 或 20x 进行展示。使用一颗20x 水镜成像时,可以看到细胞在固体基质中非常锐利和高分辨率的图像。用 10x 物镜成像虽然少了部分细节,但是拍摄速度会更快,因为每个孔只需要拍摄一个视野和更少的图层数量。更重要的是,感兴趣区域可以将原有血管和新生血管有效区分开来。血管新生芽的代表性图像如图 2 所示。
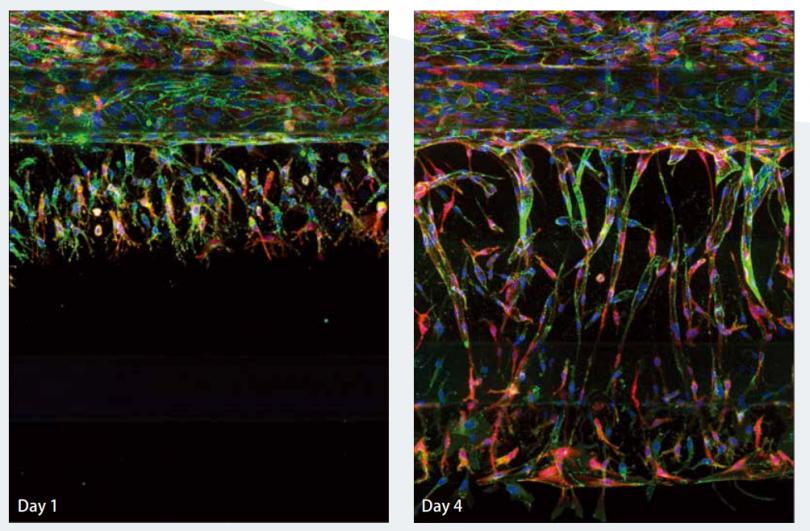
图 2 器官芯片板中血管生成芽的图像。培养 1 天和 4 天后形成的新生芽的Z大投影图像。注意图像上部的管状血管细胞。血管新生芽从上管进入含有胶原蛋白的泳道,向含有生长因子的下线延伸。核染色 (Hoechst) 为蓝色,VE-cadherin 为绿色,肌动蛋白为红色。 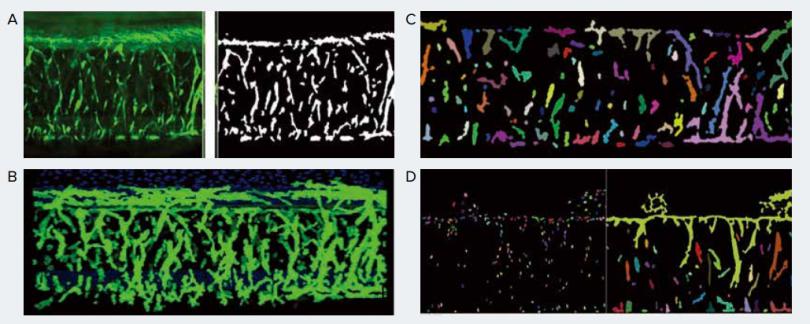
图 3 A. 成像原图及使用 CME 编辑后的图层。利用 Neurite Outgrowth 模块在每层 z-image 中识别出单个的芽和核,然后利用“ Z佳匹配连接 ”函数将每个图像中的对象进行三维连接。该分析能够识别芽的总数量,总体积,平均强度,以及核计数。B. 用 MetaXpress软件实现血管生成芽的三维可视化。C. 每幅图像中的对象通过“ Z佳匹配连接 ”功能进行三维连接。分离的芽和核显示为假色。D. 使用“Find Nuclei”模块对每幅图像中的细胞核进行识别,然后使用“connect by touching”选项对目标进行连接。
图 3 描述了使用“ Z佳匹配连接 ”功能进行图像分析的过程,包括平面分割和三维特征连接。观察到芽的数量和体积随时间而增加,细胞或核的数量也在增加 ( 图 4-5 )。
整块板的图像分析自动执行,无需用户干预。如果染色强度显著不同,可能需要在实验之间额外调整图像强度阈值。另外使用 Power Core 软件对分析也是必要的。图 6 演示了自定义模块编辑 (CME) 用于分析的工作流程。
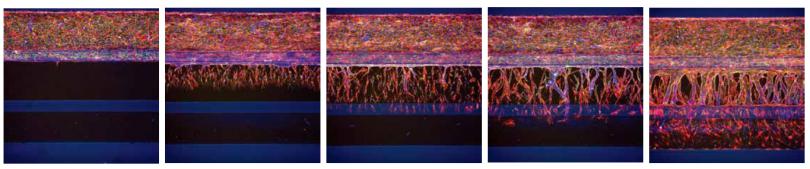
图 4 随着时间的推移,器官芯片板内的血管新生萌发 (RFP- HUVECs)。从左至右,在底部泳道用血管生成混合物分别刺激 0、1、2、3、4天,形成血管生成芽。样本染色为肌动蛋白 ( 红色 ) 和 VE-cadherin ( 绿色 )。用 Hoechst 染核。 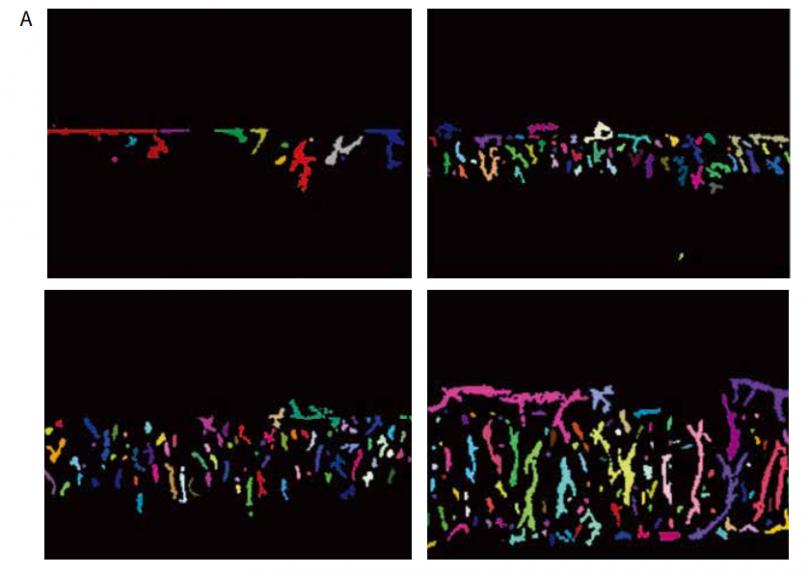
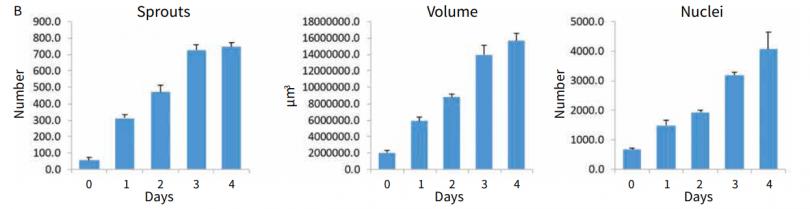
图 5 血管生成的定量评估。例如连续四天在 3D 胶原蛋白中的血管新生芽生长状况。柱状图显示了血管生成芽的定量测量。实验进行了三次,误差条代表 STDEV。
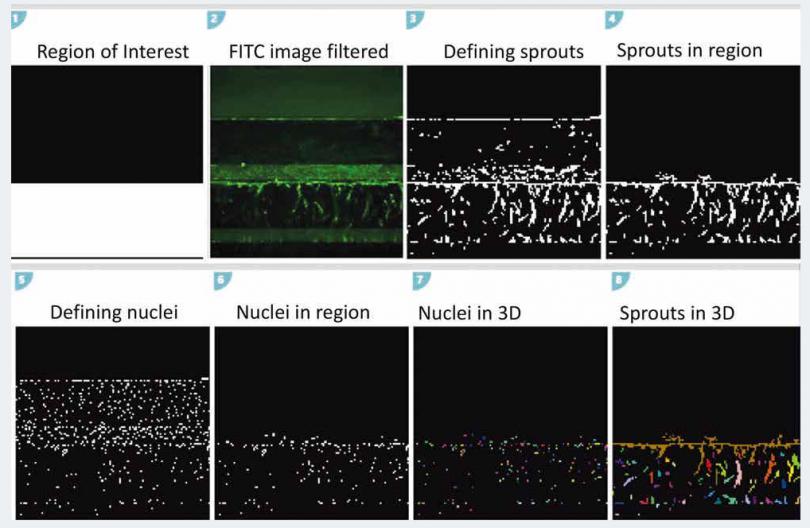
图 6 Customer Module Editor。展示自定义模块编辑器的分析步骤。
结论
从血管生成等复杂生物过程的表型变化中获得定量数据具有非常重要的意义。三维生物模型提供了一个更好的代表复杂
人类生物学的方法,而复杂的三维结构的图像分析是具有挑战性的。
我们开发和优化了一套完整的成像和分析方案,能够在 MIMETAS 平台上进行血管生成芽的拍摄、可视化及定量分析。
成像方案是基于 ImageXpress Micro 共聚焦系统和 MetaXpress 软件开发的,以提供成像和分析的集成式工作流程。
将该系统与可扩展的器官芯片平台的功能相结合,为疾病建模和化合物筛选解锁新的表型效应的定量表征。
相关产品
全部评论(0条)
推荐方案
相关解决方案
参与评论
登录后参与评论