
立即扫码咨询
联系方式:400 820 3586
联系我们时请说明在仪器网(www.yiqi.com)上看到的!
概述
本文的研究目的是确定在复杂生物测定中,使用水镜成像提高图像质量的同时是否可以应用于高通量场景。
介绍
本文涉及的所有测试均在 96/384 孔板或市售的单器官芯片板中进行。研究中使用空气镜或水镜的实验流程包括样品的激光自动聚焦等环节保持相同。研究发现,通常在相同信噪比的条件下,使用水镜可以明显缩短曝光时间;因而,基于成像过程中荧光通道数量、荧光强度以及样品是2D 成像还是 3D 成像等不同条件,整板成像的时间Z高可比标准空气物镜的快30%。此外,在需要注水之前,使用水镜可以对多达数百个样品板成像。
水镜与空气镜的比较实验如下:
• 使用鱼藤酮和氯喹处理得到剂量反应曲线,并进行线粒体融合和膜完整性评价。
• 化合物处理 HCT116 ( 结肠癌细胞 ) 后,对细胞球生长情况进行评价并计算细胞死活率。
• 用血管生成抑制剂处理后,于单器官芯片上培养复杂的 3D 血管生成样品,并采集图像数据。
此外,我们用低倍镜对整个微孔板成像,识别感兴趣的稀有个体后,可以再使用高倍的水镜自动重新成像。
材料和方法
高内涵系统 Image Xpress-confocal水镜系统硬件
实验模型
• 实验耗材:
Corning® spheroid microplates(384 well format)
Mimetas OrganoPlate® 3-Lane
InSphero Akura™ 384 well plate
Greiner SensoPlate™ - 96 and 384
• 细胞:
3D InSight™ 肿瘤微组织 (InSphero)
HUVEC ( 人类原代内皮细胞 )
HCT-116 ( 人类结肠直肠癌细胞 )
Caco-2 ( 人类结肠直肠癌细胞 )
PC-12 ( 大鼠神经母细胞瘤细胞 )

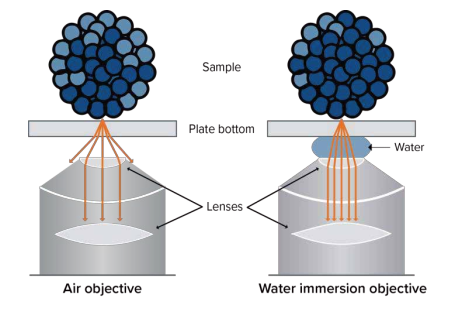
图 1 比较 20X 0.75NA 空气镜和 20X 0.95NA 水镜的细胞球重构侧视图表明,由于降低了球面畸变,图像质量得到了明显改善。 水的折射率与样品所悬浮介质的折射率更接近,因此位于平板底面上方 > 300 um 肿瘤球体的图像可以更准确地反映细胞和整个球体的形态特征,而不会出现 Z 轴的拉伸现象。 此外,使用水镜 ( FITC 波长 ) 产生相同的信号强度只需要相对空气镜1/3的曝光时间。
结果
线粒体完整性和融合测定
线粒体的形成和完整性的表征对于理解疾病的机制和毒性评估很重要。线粒体的长度、亮度和数量会在线粒体循环、代谢变化或凋亡过程中发生变化。成像后光强度和线粒体形状可以通过使用 Meta Xpress软件中的工具来确定,该工具可以通过用户自定义标准来测量“颗粒度”,“纤维数”或“自定义区域数”等指标,这些指标可以用于计算各种化合物的剂量效应和有效浓度。
器官芯片
水镜提高了物镜附近 2D 表面不平整的样本分辨率和球形度。这在做 3D 模型成像 ( 尤其是器官芯片样本 ) 时具有优势。我们使用水镜以 OrganoPlate 3-Lane 模式对芯片上肠道和血管生成模型进行成像。
3 D 筛选 ( quick ID、靶点成像 )通常,有多种用以筛选抗肿瘤药物的培养细胞球的方法。在某些拍摄过程中,椭球体并非始终位于孔的中心,这可能使得镜头很难以高放大倍数在单个视场 (FOV) 中获取感兴趣的对象。QuickID 允许我们使用 20X 的水镜对 FOV 中心的每个球状体进行自动成像,以收集多个通道的 Z 轴层扫图像,而无需获取额外的位置信息。
对细胞球活力的定量测量3D 肿瘤模型越来越多地用于癌症研究。在此示例中,我们使用从 HCT116 结肠癌细胞培养形成的 3D 球体,通过计算细胞死活率来评价药物对细胞球体的毒性作用。
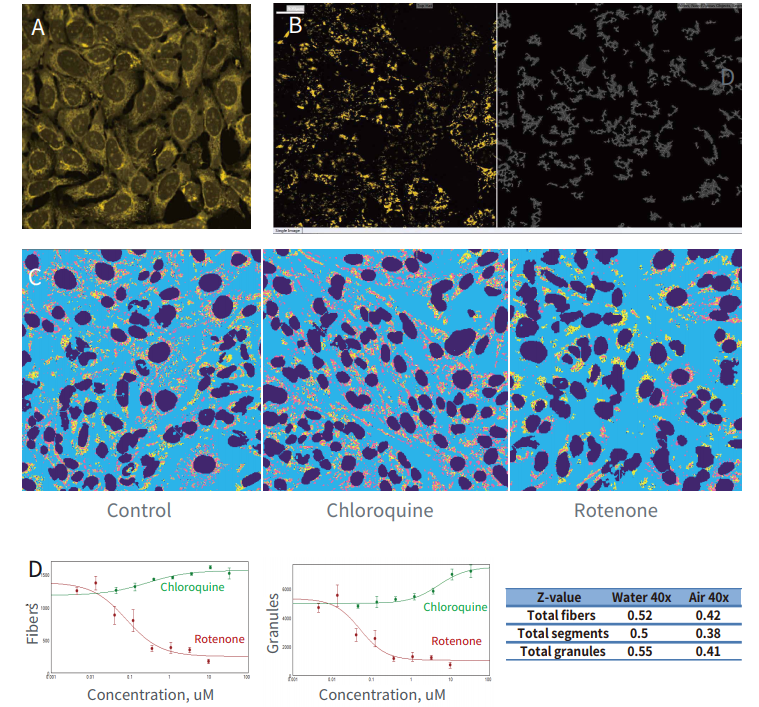
图 2 用氯喹 ( 线粒体循环抑制剂 ) 和鱼藤酮 ( 氧化磷酸化抑制剂 ) 在指定浓度下处理 PC12 细胞24 小时。 用 MitoTracker Orange CMTMRos ( 黄色 ) 和Hoechst (未显示) 染细胞,用 40X 水镜和非水镜分别拍摄图像 (A),使用 MetaXpress 软件处理数据,分析确定“颗粒度”(左) 或“纤维数”(右) (B),自定义区域模拟图层显示了完整的颗粒、纤维或区域定量 (C) ,计算 EC50 ( 四个复孔 ) ,水镜可以提高图像质量,更准确地计算颗粒数,从而获得更高的 Z 值 (D) 。
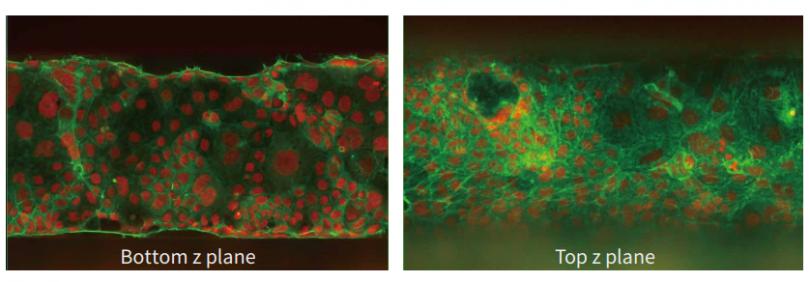
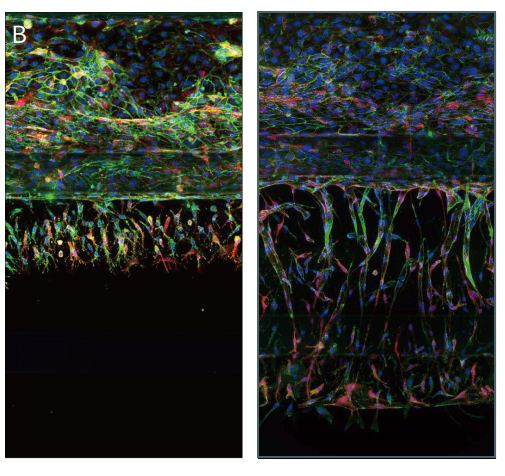
图 3 以 Mimetas 提供的方案培养Caco2 细胞,形成完整的肠管模型。用 Hoechst 和 AlexaFluor-488 耦合的鬼笔环肽对细胞进行染色,并在整个管路中拍摄Z轴层扫共聚焦图像。(A) 使用 40 倍水镜成像的细胞底层 ( 左 ) 和顶层 ( 右 ) 。(B) 拍摄鬼笔环肽-AlexaFluor 555、Hoechst和抗 VE 钙黏着蛋白染色的 HUVEC细胞的血管生成模型,用 20X 水镜采集 50 个 Z 轴的 2D 投影显示未处理的细胞 ( 右 ) 和抗血管生成化合物处理的细胞 (左) 。
结论
• 水镜非常适合标准微孔板或单器官芯片形式的自动化成像分析。
• 如果在采集过程中使用了水镜,则距板底 100 um 的物体的球面像差会降低。
• 在 384 孔板中进行 2 色分析时,使用水镜的图像采集时间Z多可减少 30%。
• 在复杂的生物学检测中,使用水浸镜头成像使图像质量以及数据质量得到了改善。
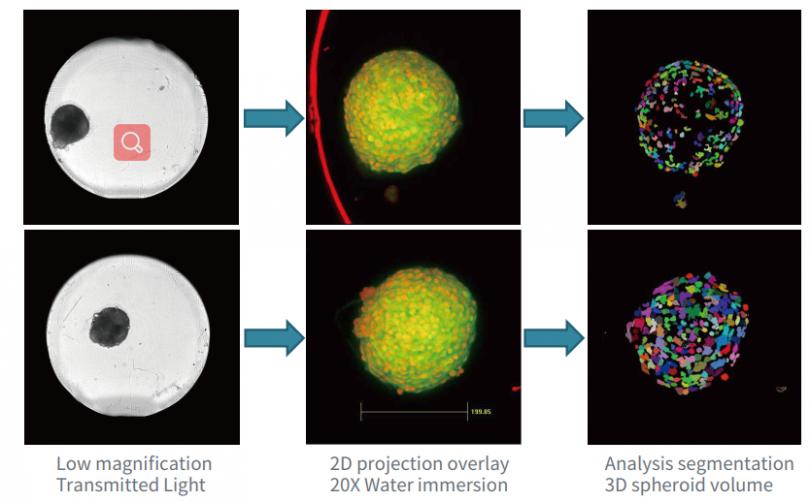
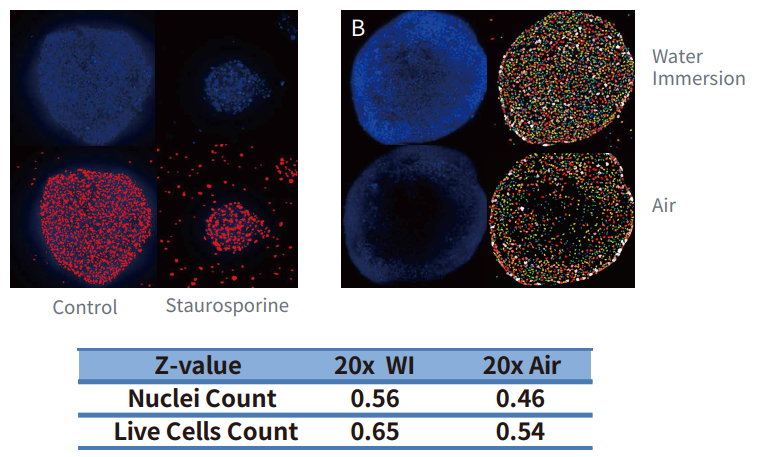
图 5 用 HCT116 细胞 ( 4000 个 ) 在 U 型底 384 孔板中的培养形成细胞球体。 antcancer化合物处理细胞球 48 小时,然后用 Hoechst 和 EthD-1 染色 3 小时 (A)。使用具有 20X 物镜的共焦选件对孔板进行成像 ( 水镜或者非水镜 (B) ) ,将 11 张间隔 10 um 的图像进行 Z 轴堆叠,然后使用核计数或自定义模块编辑器分析Z大投影图像。统计细胞核或活细胞的数量来定量 EC50 进而研究化合物的性质。由于对整个球体中细胞的计数更加精确,使用水镜会得到更大的 Z 值。
相关产品
全部评论(0条)
推荐方案
相关解决方案
参与评论
登录后参与评论