
立即扫码咨询
联系方式:400 820 3586
联系我们时请说明在仪器网(www.yiqi.com)上看到的!
介绍
在生物研究和药物发现中,越来越需要扩大细胞分析的多样性和复杂性。干细胞来源的细胞和组织在药物开发和毒理学安全性评估中日益成为传统体外和体内试验的替代选择。在本研究中,我们使用人类ipsc来源的心肌细胞和神经元细胞模型,开发功能性和形态性的检测结果,以多参数分析格式测试不同化合物的效果。
我们使用自动化的细胞成像和分析ImageXpress Pico 个人型高内涵成像分析系统同时确定钙振荡频率、细胞活力、细胞骨架完整性、细胞凋亡和线粒体功能。测定钙振荡对心肌细胞搏动频率的影响。神经球面体自动成像用于评估活细胞数量,并使用延时成像监测钙振荡。对不同检测结果的多类型复合评估提供了对各种化合物作用机制的更深入了解。实验采用了一组心脏活性药物、神经递质和选定的神经毒性或心脏毒性化合物进行表征分析。总的来说,我们的结果展示了如何利用各种各样的分析来定量筛选 iPSC 心肌细胞和神经元模型中的化学效应,并实现快速和经济有效的多维生物图谱。
CellReporterXpress 成像和分析软件
• 含 20+ 预置的实验方案
方法
环境控制和延时成像监控:
ImageXpress Pico 系统配有环境控制室,可以对温度、CO2 和 O2 含量以及湿度进行控制和监控。与延时成像相结合,它提供了一个有效的工具来执行活细胞实验,包括缺氧条件。
细胞培养: 人 ipsc 来源的心肌细胞或肝细胞及合适的培养基购自 cell DynamicsInternational,Fujifilm 公司。细胞被铺入 384 孔黑色透明底板中,每孔密度为10000 细胞,按照 CDI 的方案进行培养。用化合物处理 1 小时或 24 小时,或如图所示 。神经球面体来源于StemoniXInc(Maple Grove,MN)。
细胞染色: 为了观察 Ca2+ 振荡,细胞被加载了钙 6 染料 (MolecularDevices)。为了评估表型变化,使用三种染料的混合物对活细胞进行染色:活力染料 Calcein AM(1 mm)、线粒体膜电位染料 MitoTrackerOrange (0.2 mM) 和核染料 Hoechst(2mm) ( 均来自 Life Technologies )。为了观察肌动蛋白细胞骨架,我们用 4% 甲醛(Sigma) 固定细胞,并用 AlexaFluor 488(AF488) 标记鬼笔环肽染色。用抗 Tuj -1 抗体 (BD Biosciences) 对神经元进行染色。
干细胞分化的细胞模型
利用干细胞来源的细胞模型进行实验研究的兴趣越来越大。干细胞来源的心肌细胞、肝细胞和神经元为化合物测试和毒性评估提供了非常有用的模型。心脏毒性和肝毒性仍然是药物在临床试验和上市后撤销的两个主要原因。此外,很大一部分心血管疾病被认为是由环境暴露造成的。因此,体外筛选检测发展的一个重要目标领域包括潜在毒性作用的检测。
仪器
基于细胞水平的检测分析试验均在配有CellReporterXpress™ 成像和分析软件的ImageXpress Pico 系统上完成。该成像系统提供 4 个荧光通道和透射光延时能力,可自动监测细胞增殖、分化、化合物毒性和各种其他基于细胞的检测。
ImageXpress Pico 个人型高内涵成像分析系统
• 配备 4 色荧光通道和透射光通道;4x-63x物镜;环境控制和 Z-stack 成像模块
结果
评价化合物对心肌细胞钙振荡的影响ipsc 来源的心肌细胞是一个非常有吸引力的体外模型,因为它们形成了一个同步跳
动的单层细胞,可以使用快速动态荧光检测细胞内 Ca2+ 通量的变化,从而可靠地再现药物相关的心脏生理表型 (Grimm et al.2016; Sirenko et al. 2013)。在这项工作
中,我们已经为一个新的成像系统 ⸺ImageXpress Pico 系统采用了钙振荡分析,该系统允许活细胞分析,包括延时成像和环境控制。
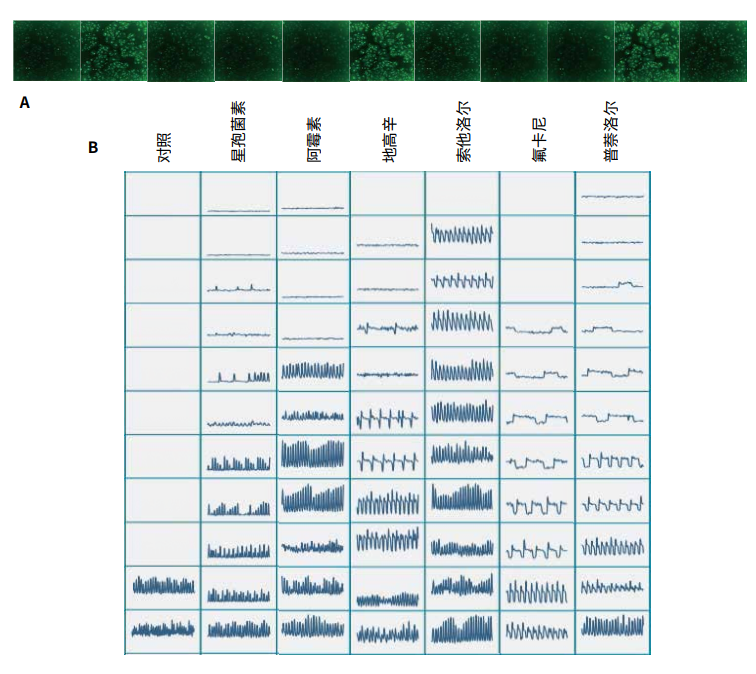
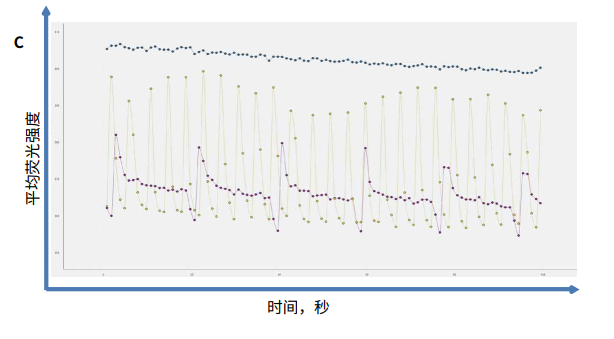
图 1. 为了测量钙振荡,iPSC 心肌细胞加载了 EarlyTox 钙染料,然后使用 ImageXpress Pico 系统在FITC 通道上以延时模式成像。A 图显示了一系列间隔 0.5 秒的图像。B. 随着相应化合物浓度的增加,出现钙振荡的痕迹。C. 对照组 ( 0.1% DMSO,黄色 )、阿霉素 ( 1 mm,蓝色 ) 或醋酸氟卡尼 ( 1 mm,紫色 )。 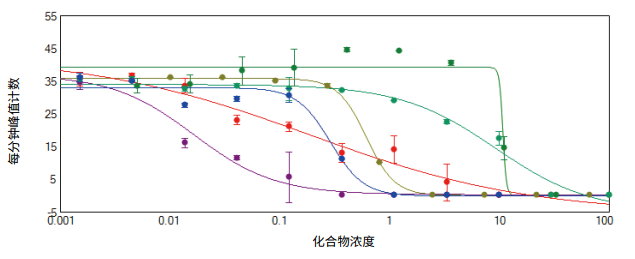
图 2. 用四参数曲线拟合,手工计算峰的数量并与化合物浓度进行对比。EC50 值计算使用 SoftMax Pro软件。西沙必利 ( 紫色 )、氟哌啶醇 ( 红色 )、星孢菌素 ( 蓝色 )、伊马替尼 ( 黄色 )、阿霉素 ( 深绿色 )、醋酸氟卡尼 ( 绿色 ) 的峰值计数随剂量变化而下降。
评估化合物对细胞活力和形态学的影响
尽管对跳动轮廓的变化的评估对于功能影响的检测来说非常重要,但是高内涵成像是用于监测化合物的形态学变化和细胞毒性效应的重要的互补测定。成像和分析方法为多种类型的表征提供了有效的工具,包括钙振荡动力学、细胞活力、细胞形状表征、细胞粘附和扩散、细胞骨架完整性( 形态学 ) 和线粒体膜电位。
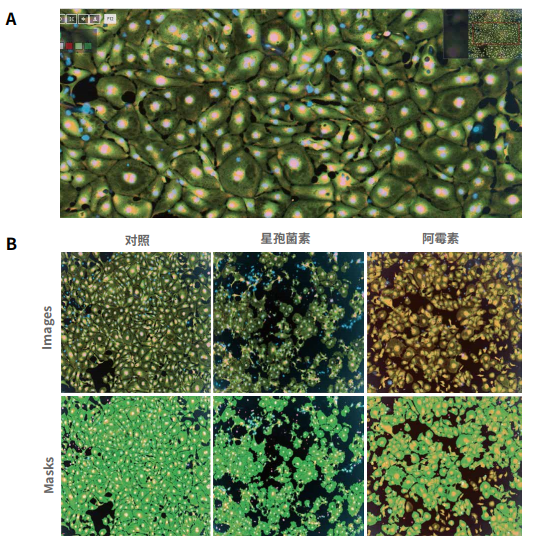
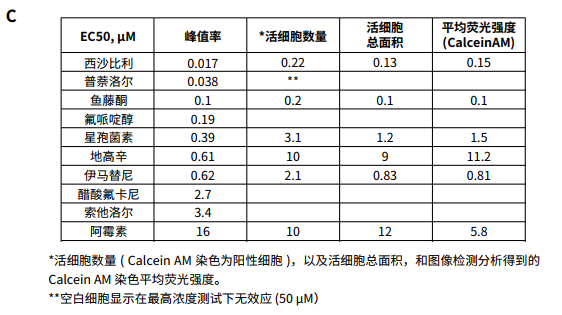
图 2. A心肌细胞图片 (20x 物镜 ) 染色活性染料钙黄绿素 (Calcein AM),Mitotracker Orange 染料检测线粒体膜电位,赫斯特核染料 ( 来自 Thermo Fisher Scientific,浓度分别是 0.5 µM,0.2 µM,和 0.5 µM)。B. 多参数分析的图像和分析掩模。I-Cell 诱导的心肌细胞在 24 小时内接受了化合物的处理然后用核染色剂 (Hoechst 33342),Calcein AM 和 MitoTracker Orange CMTMRos 染色。图像和分析掩模比较了对照细胞和 0.1 µM staurosporine 及 10 µM阿霉素处理的细胞。细胞用 DAPI、FITC 和 TRITC 用 10x PlanFluor 物镜成像。图像显示细胞核 ( 蓝色 ),CalceinAM染色 ( 绿色 ),线粒体 ( 橙色 )。使用细胞分类分析模块对图像进行分析,该模块优化了CalceinAM阳性细胞或有丝分裂细胞橙色阳性细胞的定量。分析掩膜:浅绿色阳性核,红色阴性核,绿色肌动蛋白细胞骨架。C. 表中 EC50显示了浓度依赖曲线的测量值。值得注意的是,大多数化合物显示特定心脏毒性,IC50 值浓度抑制跳动率 ½ log 或低于减少钙黄绿素阳性细胞数量的影响细胞毒性的浓度。与此相反,阿霉素的细胞毒性作用与抑制跳动速率的浓度相似。
评估化合物对神经球的影响
评价细胞毒性效应,来自 StemoniX 公司microBrain 3D cells 用各种神经毒性化合物处理 24 小时。为了评价钙振荡,细胞内加入钙 6 染料。利用延时成像技术对钙离子振荡进行可视化,然后以整个球体为“细胞”对象,用细胞计数分析法对图像进行分析。然后根据时间绘制出平均强度图,这样可以直观地看到钙振荡的模式。细胞毒性评估用 Hoechst 核染色、MitoTracker 橙色染料、Calcein AM染色检测细胞活力。
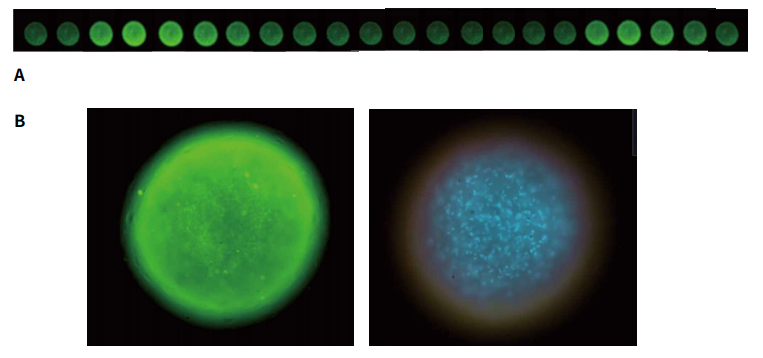
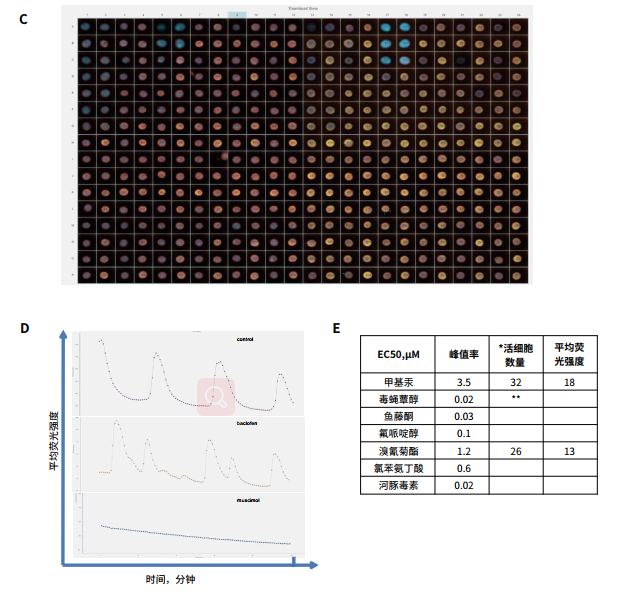
图 3. A. 神经球面体显示的延时图像串。为了测量钙振荡,将 ipsc 来源的神经球面体 (StemoniX) 加载钙6 染料,然后用 ImageXpress Pico 系统在FITC 通道中用延时模式成像。所示图像是间隔 1 秒拍摄的。B. 球体钙6染色图像 ( Molecular Devices,染色 2 小时,左图 );或 3 种活性染料的组合: Hoechst、Calcein AM 和 MitoTracker 橙色,如下图 ( 右侧 ) 所示。C 为进行细胞毒性评估,球状体被三种染料组合染色 2 小时,分别是 Hoechst (2 µM), MitoTrackerOrange (0.2 µM)、Calcein AM ( 2 µM,均来自Thermo Fisher Scientific )。在ImageXpress Pico 个人型高内涵成像分析系统中,使用 10x Plan Fluor物镜,以及 DAPI、TRITC 和 FITC 通道拍摄图像。图像处理采用细胞分类分析算法。不同化合物处理的神经球面体 CalceinAM 或 MitoTrackerOrange 染色减少。D. 钙振荡的痕迹显示了对照组 (0.1% DMSO)氯苯氨丁酸 (1 µM) 和毒蝇蕈醇 (1 µM) 的结果。E. 表中列出了从浓度依赖曲线得到的 EC50值。
总结
我们提出了利用 ipsc 衍生的人类心肌细胞和神经球体进行复杂多参数分析的方法;
多重结果可以表征不同化合物的表型效应,也可以评估有效浓度;
本研究展示了利用 ImageXpress Pico系统和 CellReporterXpress 软件进行各种生物效应评估的成像分析的广泛应用
特性。
相关产品
全部评论(0条)
推荐方案
相关解决方案
参与评论
登录后参与评论