
立即扫码咨询
联系方式:400 820 3586
联系我们时请说明在仪器网(www.yiqi.com)上看到的!
前言
建立生理相关的体外模型对于进一步了解神经疾病的机制以及靶向药物开发至关重要。iPSC 衍生的神经元显示出对化合物筛选和疾病建模的巨大希望,然而目前已经出现了使用三维 (3D) 培养物作为对神经元细胞的测定开发的有效方法。3D 培养被认为是更接近人类组织的重演方式,包括结构,细胞组织,以及细胞 - 细胞和细胞 - 基质相互作用1,2。
本研究的重点是利用微流控 OrganoPlate平台培育的 iPSC 衍生神经元开发高通量 3D神经突向外生长测定方案,目标是建立神经退行性疾病和神经毒理学筛查的 3D 模型 3。OrganoPlate 是一个高通量平台,结合了新近的 3D 细胞培养技术,Phaseguides™和微流体技术 4,5,6。OrganoPlate 包含 96 个适合长期培养活细胞的组织芯片,适用于筛选目的,并且与标准实验室设备或自动化系统兼容,如 ImageXpress Micro Confocal高内涵成像系统。
材料
• OrganoPlate 平台 (MIMETAS)
• 人源 iPS 诱导 iCell 神经元细胞(Cellular Dynamics International)
• 神经基质(Cellular Dynamics International)
• 人工基底膜 (Corning)
• 钙荧光素乙酰氧基甲酯(Life Technologies)
• MitoTracker Orange(Life Technologies)
• Hoechst (Life Technologies)
• 皂素 (Sigma)
• PBS(Sigma)
• Αντι-β-tubulin III(TUJ-1) 抗体 (BD Biosciences)
• ImageXpress Micro Confocal 高内涵成像系统 (Molecular Devices)
• MetaXpress 高内涵图像拍摄及分析软件, Ver 6.2 (Molecular Devices)
3D 模型中神经元网络的形成
使用微流体培养模式进行细胞培养,化合物处理和细胞染色步骤。对在 3D 基质中培养的神经元进行共聚焦成像和分析方案的优化,用于评估形态学表型和活力。与Matrigel 预混合,使 OrganoPlate 中Matrigel 终浓度为 7mg / ml ,然后将人iPSC 衍生的神经元以 30,000 个细胞/芯片的密度接种。接种 Matrigel 细胞悬浮液时保持在冰上操作。该溶液的接种体积在每片 1-1.4 μL 之间变化,取决于细胞密度和基质胶浓度。接种后,将板置于组织培养箱 (37℃,5% CO2) 中 30 分钟,以促进基质胶的聚合。接下来,将 50 μL 生长培养基添加到芯片的中间入口和出口,然后放回组织培养箱中。在平板接种后约 24 小时形成神经突向外生长,并持续培养 14 天。为了评估 OrganoPlate 平台测试神经毒性和神经元发育的可行性,这些神经元培养物用一系列已知的抑制神经突向外生长的化合物进行处理 7。在铺板后 24 小时开始
化合物处理。将培养物暴露于外源处理下 5天,在此期间每隔一天更换含有化合物的培养基。在添加到 OrganoPlate 芯片的介质入口和出口之前在介质中施加适当的Z终稀释液来进行化合物稀释。
优势
• 使用 iPSC 衍生神经元建立高通量 3D 神经突向外生长测定
• 使用微流体 OrganoPlate 平台生成更多模拟体内结果
• 优化高内涵成像,评估对神经元网络的治疗效果

使用透射光成像随时间监测神经突网络的形成。为了评估神经元活力,使用三种染料的混合物对细胞进行活体染色:活
性染料 Calcein AM (1 μM),线粒体染料MitoTracker Orange (1 μM) 和 Hoechst核染料 (2 μM)。将染料混合物加入到芯片中并孵育 60 分钟,然后用培养基替换。或者,将细胞固定在 4% 甲醛中,用 0.01%皂苷溶液在 PBS 中进行穿透,并使用抗β - 微 管蛋白III (TUJ-X1) 的神经元标记物 ( 1 :100 稀释 ) 的荧光基团抗体进行染色。 细胞核用 Hoechst 染色。染色固定细胞时用一抗在 4 ℃ 下孵育过夜。
3D 培养的表型分析
通过高通量的成像和分析来进行对神经网络的治疗效果的评估。我们优化了共焦成像和分析方案,在这个 3D 模型内评估神经元的形态和生存能力。使用 ImageXpressMicro Confocal 系统的 10x,20x,或 40x的物镜来进行图像拍摄。在焦点轴 ( Z 堆栈 ) 的不同平面上获得一系列图像 ( 图 1 )。得到了 3 ~ 10 μm 厚度的 17-30 个面层,深度约 150 ~ 300 μm。所有单层的图像都被保存并用于 3D 分析, 以及 2D 投影 ( Z大投影或Z佳聚焦 ) 图像。
本次获得的 2D Z大投影图像分析
使用 Meta Xpress 高通量图像采集和分析软件对图像进行分析。这些图像的自动定量分析使用了两种方法:投影图像的分析 (2D) 或 Z 叠加后的 3D 图像分析。为了对投影图像进行分析,在采集时将Z-Stack 图像转换为 2D 投影图像,然后使用 MetaXpress Neurite Outgrowth 应用模块进行分析。表型读数包括通过几个端点测量来定量表征神经网络的范围和复杂性, 这些端点测量包括:总神经突起生长、过程和分支的数量,以及细胞数量和生存能力。本次得出的Z佳聚焦投影图像用于透射光图像的分析。投影图像的分析是快速的,同时提供了神经网络的生长范围的准确估计。然而,二维分析有其局限性,因为这种方法无法进行体积测量,并且通常只计算物体的一小部分。图 2 和图 3 显示了对照组和鱼藤酮处理的神经元培养物的复合荧光图像,这些神经元培养物具有用于测量神经突起生长的“分析图层”。测量结果包括总突起生长,分支数,过程,总细胞数 ( 细胞体 )。图 4 显示神经突起生长长度、分支数目和细胞活力随着接触神经毒性化合物而减少,这些化合物包括:三苯基磷酸酯、 四乙基硫脲、六氯苯基、鱼藤酮和甲基汞 ( 每种 10 μM )。
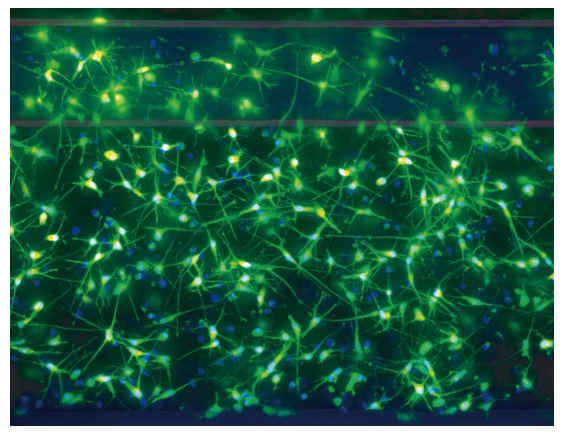

图2 神经元活细胞染色。 iCell 神经元细胞接种于 OrganoPlate 微孔板的基质胶内,每孔约 30,000 个细胞。细胞培养 5 天,然后用活性染料 Calcein AM、线粒体完整性染料 MitoTracker Orange 和Hoechst 核染料对活细胞进行染色。然后使用 ImageXpress Micro Confocal 系统,在共具焦模式下,使用 60μm 针孔旋转盘结构,DAPI、FITC 和 TRITC 通道,20 倍物镜,以 6 μm 步径拍摄 25 幅图像,获得了 3 色的 Z 叠加图像。这里给出了本次实验中 DAPI 和 FITC 通道的Z大投影合成图像。
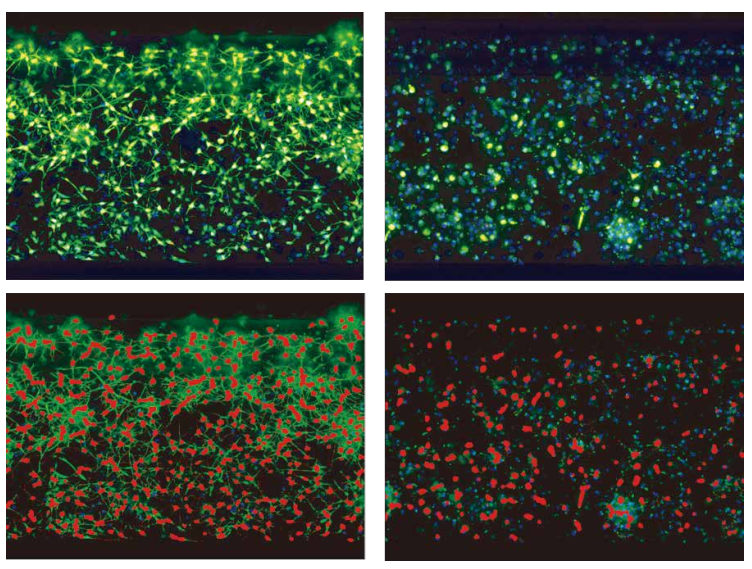
图 3 神经元网络的 2D 分析。 iCell 神经元以每片 30,000 个细胞的密度培养 24 小时,然后用化合物处理 5 天,随后用钙调素 AM、MitoTracker Orange 和 Hoechst 染色活细胞。在共具焦模式下,使用ImageXpress Micro Confocal 系统的 60 μm 针孔旋转圆盘模式,在 20 倍物镜下拍摄了 3 色的 Z 叠加图像。以上得出的Z大投影图像使用 MetaXpress 神经突起生长应用模块进行分析。细胞体和突起的分析图层用红色标识。图像展示出了对照组图像 (DMSO) 和鱼藤酮 ( 10 毫米 ) 处理的细胞。作为复合治疗的结果,神经元连接的崩解是可以被检测的。
3D 可视化和 3D 图像分析
MetaXpress 软件提供了 3D 分析选项,允许组合来自相邻 Z 平面的对象,以及细胞和网络的 3D 可视化。使用 3D 分析自定义模块分析图像,利用“查找纤维”功能生成用于定量神经突起生长的“纤维”测量;细胞核也可以用于细胞计数。首先在每个平面中找到对象,然后使用“Z佳连接”函数在 3D 空间中进行连接。3D 分析通常是密集处理型的,但是可以提高 3D 空间中物体 ( 包括多个重叠物体 ) 的分辨率和数量。从 3D 分析种输出的测量结果包括神经突 ( 纤维 ) 的数目、细胞体积、纤维总体积 、 突起数目和分支点 。 通过寻 找Hoechst 染色阳性的“球形物体”来确定细胞总数 ( 细胞核 )。图 5A 显示了“纤维”和“核”的分析图层。另一个定制模块用于表征细胞活力 ( CalceinAM 阳性的细胞体 ) 和线粒体完整性 ( MitoTracker Orange阳性的细胞体 ) 的测量。利用三维细胞评分分析对活细胞 ( CalceinAM 阳性 ) 和线粒体完整细胞 ( MitoTracker阳性细胞 ) 进行计数和表征。通过该分析方法计算的结果包括:细胞数 ( 总核 )、活细胞数 ( 钙调素 AM 阳性 )、MitoTracker阳性细胞数、以及细胞体积或荧光强度。图 5B 和 5C 示出了“钙黄绿素 AM 阳性细胞质”、“MitoTracker 阳性细胞质”和“细胞核”的分析图层。图 6 给出了几种表征神经突起网络复合效应的测量值:突起 (“纤维”) 和分支点的数量以及具有完整线粒体的活细胞或细胞的数量的减少。

图 4 特定化合物对神经元网络影响性的 2D 分析。 iCell 神经元如图 2 所示进行培养,并用所指示的神经毒性化合物处理 5 天。在共聚焦模式下,使用 ImageXpress Micro Confocal 系统,使用 60 个旋转盘模式、20 倍物镜,拍摄了 3 色的 Z 叠加图像。使用神经突起生长分析模块对本次产生的Z大值投影图像 ( 3D 系列图像的 2D 投影 ) 进行分析。化合物的浓度 (10 μM) 对总生长量、活细胞数、分支数和突起数有定量影响
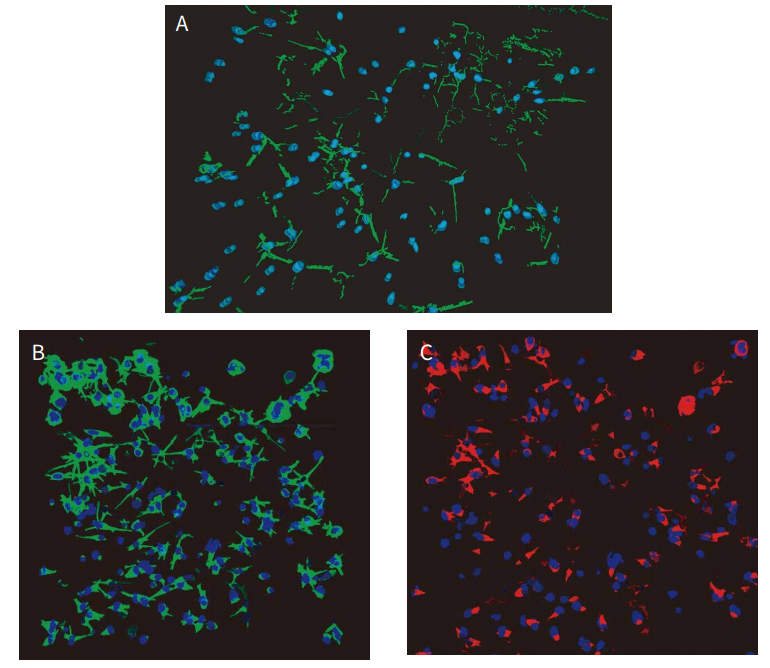
图 5 神经元网络的 3D 分析。 如图 2 所示方法对细胞进行处理和染色,。使用 MetaXpress 自定义模块编辑器的 3D 分析选项分析 Z-stacks 图像。用两种不同的分析模块来评估 3D 中神经网络的复杂度:测量纤维 ( 神经突起 ) 和阳性细胞评分 ( 标记表达 )。 (A) 在自定义模块编辑器 (CME) 中使用“查找纤维”和“通过Z佳匹配连接”选项,在 3D 空间中检测和计数神经突 ( 纤维 ) 的数量和体积以及节段和分支点。显示了纤维 ( 绿色 ) 和核 ( 蓝色 ) 的可视化。 (B) 应用"细胞评分"和 CME 的“Z佳匹配”功能,在3D 空间测量总细胞数、钙素 AM 阳性“活”细胞和钙素 AM 阳性细胞质体积。细胞核用蓝色显示,绿色为阳性细胞质。 (C) 在 CME 中使用“细胞评分”和“Z佳匹配连接”选项测量 MitoTracker 染色阳性细胞的数量和 MitoTracker 染色阳性细胞质的体积;细胞核呈蓝色显示,线粒体呈红色
使用 OrganoPlates 进行 3D 神经毒性分析
表型读数包括通过多重测量定量表征神经网络在 3D 中的范围和复杂性。在这个神经元模型系统中,我们评估了试验的重复性,表征了多次测量,并测试了几种已知的神经毒性化合物。通过这些分析方法,我们精确地测量了这些化合物对神经突起网络复杂性的浓度依赖性抑制作用。因此,本文提出的方法可用于高通量、高含量化合物筛选并用于神经毒性的预测。
结论
我们开发了一种定量的、共聚焦的高通量成像方法,该方法能够使用 MIMETASOrganoPlates 的神经元培养系统进行高通量表型评估,表征对 3D 神经元的存活率和形态的影响。共具焦成像和多参数 3D 分析允许对神经突进行计数和表征,并且还提供了神经突发育和分支在 3D 模型中的统计特征。该分析方法能够对神经元网络进行表征,并提供可用于确定 EC50 值和比较所选化合物的毒性效应的定量测量。
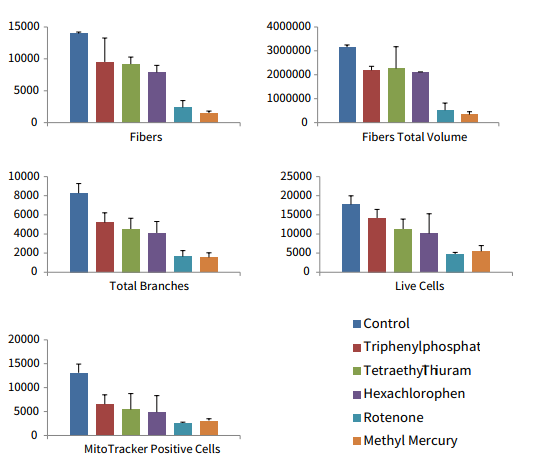
图 6 特定化合物对神经元网络影响性的 3D 分析。 iCell 神经元如图 2 所示进行培养,并用指示的神经毒性化合物处理 5 天。10 μm 浓度在三维测量结果中有不同的测量值。在三维空间中检测和计数神经突起 ( 纤维 ) 和分支点的数量和体积。此外,还计数了细胞总数、钙调素 AM 阳性“活”细胞和 MitoTracker Orange 阳性细胞,并用 3D 进行表征。给出了化合物对神经突 ( 纤维 ) 的数量和总体积、分支点数目、总数、活细胞和 MitoTracker Orange 阳性细胞的数量影响
相关产品
全部评论(0条)
推荐方案
相关解决方案
参与评论
登录后参与评论