
立即扫码咨询
联系方式:400 820 3586
联系我们时请说明在仪器网(www.yiqi.com)上看到的!
介绍
对环境中未经检验的化学品日益普遍的关注已经产生了开发可靠和有效的筛选工具以识别可能影响人类健康的1,特别是神经系统发育的化学物质的迫切需求。我们评估了一种神经突向外生长的测定方法,通过筛选和表征所选化合物的活性,评估其是否可能对发育中的神经系统产生不利影响。选择该测定法是因为其在神经系统发育关键过程的模型具有一定相关性,特别是神经元会通过延伸其神经突以形成完整的神经网络2。破坏这一过程可能会对人类和啮齿动物产生不利影响,因此研究表明,未成熟、发育中和成熟的神经突是化学毒性的靶标3。
虽然神经突向外生长测定主要用于评估发育神经毒性,但也可用于评估通过检测神经突收缩的神经变性。此外,该测定还有可能与评估成年神经元中的神经可塑性相关4。对于筛选测定,总神经突向外生长通常是指标报告中Z常见的度量标准1,5。利用自动成像还能够对其他特征进行多参数评估,例如总分支数和总过程数,以评估化合物可抑制神经突向外生长的不同方式6,7。
材料
• ImageXpress Nano 自动成像系统,配备 CellReporterXpress 自动图像采集和分析软件 (Molecular Devices)
• iCell 神经元(Cellular Dynamics International)
• Poly-d-赖氨酸预包被 384 孔板(Corning Life Sciences)
• 层粘连蛋白 (Sigma- Aldrich)
• 多聚甲醛 (Sigma-Aldrich)
• 胎牛血清 (Sigma-Aldrich)
• β-微管蛋白 III(TUJ-1) (BD Biosciences)
• Hoescht (ThermoFisher Scientific)
• 抗 β-微管蛋白抗体 (BD Biosciences)
• Calcein AM (ThermoFisher Scientifiic)
利用基于 iPS 细胞的神经突生长测定法鉴定具有神经毒性的化合物
由国际细胞动力学会 (CDI) 提供的人 iPSC衍生的神经元 ( 即 iCell 神经元 ) 细胞,是由有丝分裂后 GABA 活性基团和谷氨酸能神经元组成的混合物。这些研究中使用的神经元已经由制造商培养成完全分化和纯化的细胞群,并已形成对神经元标志物β-III 微管蛋白和 MAP28 呈阳性的神经突网络。细胞收到时为冷冻状态,随后解冻并根据 CDI 推荐的方案铺板。将细胞接种在聚-d-赖氨酸预包被的 384 孔板上,并用3.3μg / mL层粘连蛋白进行处理。在化合物处理之前,每孔接种 7,500 个细胞,并在 iCell Neurons 培养基中生长 48 小时。这些细胞中的神经突网络通常在接种后约24 小时开始形成,并且在培养至 10-12 天时开始增加复杂性。在接种后 48 小时,我们神经突向外生长进行评估,与此同时,神经元也可能发生神经突萎缩。在 6种浓度范围 ( 0.3,1.0,3.0,10.0,30.0 和 100μM ) 中一式两份测试化合物。每个平板中包括多个 DMSO 对照 (n = 16) 和未处理的对照 (n = 16)。使用高达 0.3% 的 DMSO来评估测定中的溶剂效应。将细胞在 37℃和 5% CO2下暴露于化合物下 72 小时。接着,除去培养基,用 4% 多聚甲醛固定细胞 2 小时。用含有 1% 胎牛血清和 0.01%皂苷的 PBS 中的进行透化。随后, 将细胞与抗 β-微管蛋白 III (TUJ -1) 抗体 ( 1:100稀释 ) 和 2 μg / mL Hoechst 的结合 AF488染料的小鼠抗人抗体孵育 3 小时。 β-微管蛋白用作神经突向外生长的标记物,也用于完整神经元细胞体的计数。温育后,用磷酸盐缓冲盐水 (PBS) 替换染色溶液。或者,还可以使用活细胞进行神经毒性测定,用钙黄绿素 AM 和 Hoechst 染料 ( 分别为 0.5 μM 和 2 μM ) 染色 30 分钟。有关接种密度优化的详细信息和 384 孔格式测
定的方案在 Sirenko et al.6 中有详细描述。
优势
• 使用 iPSC 衍生神经元建立高通量 3D 神经突向外生长测定
• 使用微流体 OrganoPlate 平台生成更多模拟体内结果
• 优化高内涵成像,评估对神经元网络的治疗效果
使用 ImageXpress Nano 自动成像系统的10 倍 Plan Fluor 物镜拍摄各孔的图像。在384 孔板中的每个孔的单个位点捕获一个10x 图像。10x 物镜提供了足够的分辨率来区分每个图像中大量细胞 (500-1,000)的神经突网络和亚细胞结构,能覆盖表总孔面积的约 1/4。在获取图像之后,使用CellReporterXpress™ 自动图像采集和分析软件完成所有图像分析,该软件包含用于神经突向外生长和活力评估的图像处理应用模块。作为图像处理的示例,图 1 表示出了来自神经突图像和相应分析图层的放大的典型图像。图 2 显示来自 DMSO 处理的神经元和化合物处理的神经元的图像,在其相应结构上有软件追踪的覆盖图层。
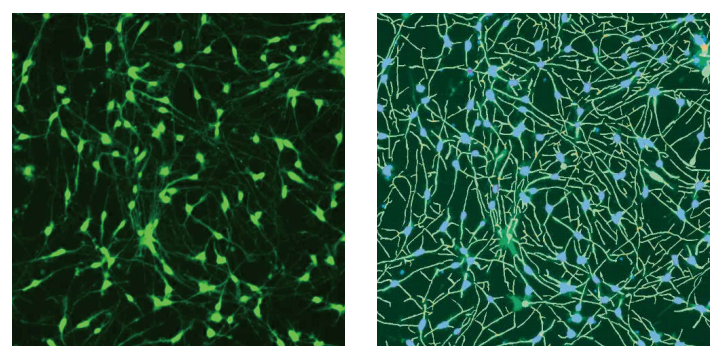
图 1 ß-微管蛋白 ( 绿色 ) 染色的图像和对照细胞的软件分析轨迹。 将 iCell 神经元铺板培养 5 天,然后固定,并用 AF 488 结合的抗-β-微管蛋白 (TUJ-1) 抗体 (1:100) 染色。图像由 ImageXpress Nano 系统使用 10x Plan Fluor 物镜和 FITC 通道拍摄。使用 CellReporterXpress 软件中的 Neurite Tracing 分析算法处理图像。右侧的分析图层显示细胞生长 ( 绿色 ) 和细胞体 ( 蓝色 )。
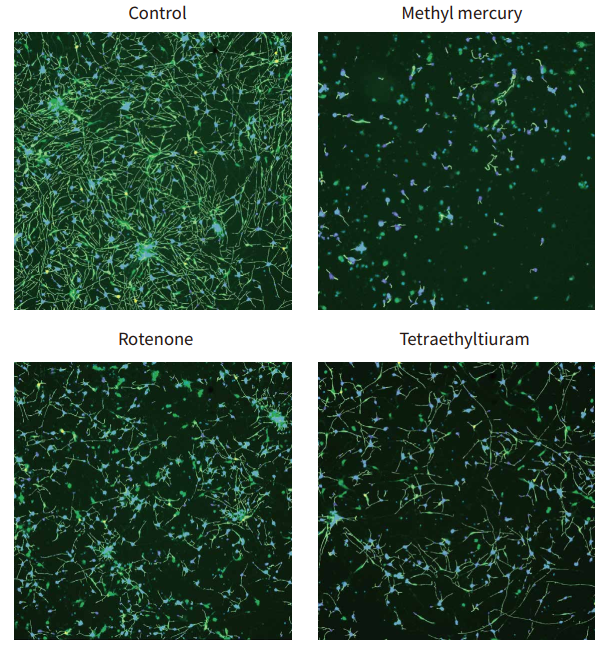
图 2 ß-微管蛋白 ( 绿色 ) 和 Hoechst ( 蓝色 ) 的复合图像,显示对照细胞和用所选化合物处理的细胞的分析轨迹。 将 iCell 神经元铺板 48 小时,用化合物处理 72 小时,然后固定并用 Hoechst (2 μM) 和带 AF 488 荧光的抗 TUJ-1 抗体 (1:100) 进行组合染色。图像由 ImageXpress Nano 系统使用 10xPlan Fluor 物镜进行 DAPI 和 FITC 通道拍摄。使用 CellReporterXpress 软件中的 Neurite Tracing 分析算法处理图像。观察到用指定化合物处理的神经元中破坏的神经突网络和细胞死亡。
使用多参数图像分析对神经元网络的复杂性进行定量分析
我们观察到由于化合物处理效应导致的神经元网络形成的剂量依赖性抑制 ( 图 3 )。在这些实验中获取的图像的定量分析包括多个参数的测定,以全方位评估培养的神经元的形态特征,以及神经元网络的复杂程度和生长程度。具体而言,神经突向外生长的特征在于生长的程度 ( 例如,总生长的长度或每个细胞的平均生长长度 ),神经突过程的数量( 例如,过程的总数和每个细胞的平均过程数 ),以及分支的程度。( 例如,分支的总数和每个单元的平均分支数 )。在整个实验中,细胞铺板和神经突向外生长均匀,因此我们可以使用每个图像的特征 ( 分支和过程 ) 的总数进行统计分析。此外,定量每个图像中 β-微管蛋白 ( TUJ-1阳性 ) 或钙黄绿素 AM 阳性细胞体的数量以评估化合物诱导的细胞死亡。同时还测量了每个细胞的生长长度以及每个细胞的过程和分支的数量,但由于信息冗余而未用于统计分析。化合物的毒性作用可以通过 EC50 值 ( 对神经突向外生长的抑制程度达到50%时的化合物浓度 ) 进行比较。EC50 值来自 4 参数曲线拟合,神经突向外生长、分支数、过程数和活细胞体数量。图 3 显示了神经突网络总长度( 总生长 ) 和分支总数的浓度依赖曲线。这些测量可以让我们定义有效的毒性浓度,比较化合物的潜在神经毒性效应,并优先进行进一步的毒性评估。
评估剂量效应以获取复合参数
使用 Hill 模型评估浓度响应曲线以得出 EC50 浓度值。表 1 中列出了不同读数的 EC50 值。在 16 种被测化合物中,其中11 种进行处理之后导致神经突向外生长减少以及分支和过程数量减少。在这 11 种化合物中,其中 6 种化合物的处理也导致细胞体数量减少。其他 5 种被测化合物具有相对较小的影响,因此未确定 EC50 值。抑制总分支数和总生长终点的 EC50 值表现出高度一致性。在较低浓度下神经网络的破坏与特定处理条件下的细胞毒性效应相比差别是显著的。因此,测量细胞体数量减少的 EC50 值通常高于用这些化合物处理时抑制神经突向外生长的 EC50 值。
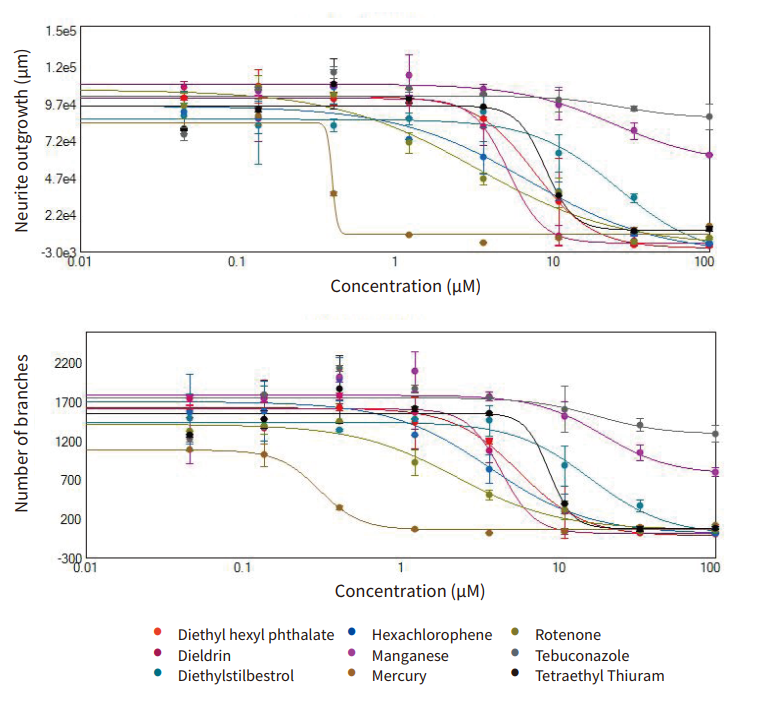
图 3 由鬼笔环肽染色的活心肌细胞的剂量 - 反应曲线。 通过分析由化合物处理诱导的细胞骨架完整性的细胞毒性作用来确定细胞活力。使用 CellReporterXpress 软件中的细胞评分分析算法对用于鬼笔环肽 ( 肌动蛋白染色为绿色 ) 染色阳性的活细胞总数进行定量。用 4 参数曲线拟合绘制浓度依赖性响应曲线,以获得包括在表 1 中的 EC50 值。
结论
神经突向外生长测定是一种有效且高效的高通量筛选实验方法,适用于评估大型化学化合物库的神经毒性。这种筛选能进行化合物的快速鉴定、评估和优先排序,以评估其在人体中可能诱导的神经毒性。该测定还可用于评估可能对神经元发育具有神经保护或促进作用的化合物。ImageXpress Nano 系统是一种有效的筛选工具,可用于进行适合于高通量筛选活动的高级表型分析。
相关产品
全部评论(0条)
推荐方案
相关解决方案
参与评论
登录后参与评论