发布:
上海胤煌科技有限公司时间:
2022-03-18行业:
制药/化妆品 生物制药生物蛋白制剂微粒异物检测探讨
一、案例分析说明
我们首先认识一下什么是生物蛋白制剂:
生物蛋白制剂是指用于预防、诊断的蛋白质类物质生物药物,比如胰岛素、内啡肽等等,与小分子药物相比,蛋白质药物具有高活性、特异性强、低毒性、有利于临床应用的特点,具有广阔的应用前景。
生物蛋白制剂同样需要检测澄清度、不溶性微粒、可见异物(参考《中国药典2020版》)。本文通过某生物医药公司药用蛋白制剂的3个检测指标,来进行颗粒物案例分析。
二、检测方法和结果
待检样品:某生物医药公司蛋白制剂
检测方法:依据《中国药典2020版》0902澄清度检查;0903不溶性微粒检查;0904可见异物检查。
0902 澄清度检查
检查目的:比较不同批次样品的澄清度
检查方法:中国药典0902第1法(目视法)
仪器设备:HN-200A澄清度检查专用伞棚灯
测试流程:
1、样品准备:不同编号样品(A、B、C、D)于冰箱中取出。
2、检测过程:开启HN-200A澄清度检查伞棚灯电源,调节白色光源旋钮,经过标准照度计测量,将灯光强度调节至1000 lx±10%范围,将待测样品置于目视窗口,人眼水平观察。
测试结果:
图1显示的是不同编号蛋白制剂样品在HN-200A澄清度检查专用伞棚灯下的实物照片,从中可以看到样品A的澄清度Z差,样品D具有极好的澄清度。

图1.不同样品在HN-200A澄清度检查专用伞棚灯下的实物照片
0903 不溶性微粒检查
检查目的:检测药用蛋白制剂中的不溶性微粒数量
检查方法:中国药典0903第二法(显微计数法)
仪器设备:YH-MIP-0103显微计数法不溶性微粒分析仪
测试流程:
1、样品准备:取0.45μm微孔滤膜 (直径13 mm)置于过滤装置上,将0.4 mL待测样品倒入过滤装置,进行抽离过滤;过滤结束后,将滤膜转移到培养皿中,于低温下烘干。
2、检测过程:样品滤膜取出后放入到YH-MIP-0103显微计数法不溶性微粒分析仪的测试台上,调整测试参数,于100倍的放大倍率下进行聚焦扫描,测试结束后得到一张包含样品不溶性微粒的大图以及详细的粒子粒径和数量报告。
测试结果:
由于测试样品体积为0.4 mL,故其测试结果判定标准参照《中国药典-0903不溶性微粒检查》章节中小容量体积的标准。
表一:《中国药典-0903不溶性微粒检查》结果判定标准
总量≥100 mL | 总量<100 mL | |||
尺寸 | ≥10 μm | ≥25 μm | ≥ 10 μm | ≥25 μm |
数量 | <12/ mL | <2/ mL | <3000/容器 | <300/容器 |
在此章节中,药典规定:光阻法不适用于黏度过高和易析出结晶的制剂,也不适用于进入传感器时容易产生气泡的注射剂。当光阻法测定结果不符合规定或者供试品不适于光阻法测定时,应采用显微计数法进行测定,并以显微计数法的测定结果作为判定依据。
测试数据:
表二:不同样品的不同尺寸范围微粒的数量及判定结果
样品编号 | 粒子数N | 判定结果 | |
尺寸≥10μm | 尺寸≥25μm | ON/NG | |
A | 480 | 137 | ON |
B | 591 | 72 | ON |
C | 563 | 66 | ON |
D | 332 | 24 | ON |
以上A、B、C、D样品不溶性微粒的测试结果表明该系列样品中的不溶性微粒检测符合《中国药典-0903不溶性微粒检测》章节中的检测标准。从不同样品的不溶性微粒的测试结果来看,可以看到样品A中尺寸≥25 μm的粒子数量Z多,而D样品中尺寸≥25 μm的粒子数量Z少,这与澄清度检查章节中的测试结果具有很好的关联性。
图2为样品A的显微计数法不溶性微粒扫描的全局图以及部分图,从图2 (b)、(c)中可以清晰地观察到样品制剂里面的不溶性微粒的形状,表明该测试结果可以作为辅助手段鉴别不溶性微粒的来源。
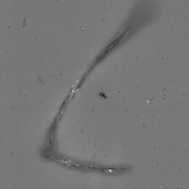


图2.样品A显微计数法不溶性微粒检测全局图片(a),部分图片 (b) (c)。
0904 可见异物检查
检查目的:观察样品制剂中的可见异物
检查方法:中国药典0904第1法(灯检法)
仪器设备:Lu -200A可见异物检查专用伞棚灯
测试流程:
1、 仪器准备:进行可见异物检测时应避免引入可见异物,测试环境应为无菌无尘环境。检测前应对容器外壁进行擦拭,必要时将药液转移至洁净透明的适宜容器中进行观察。
2、 检测过程:打开Lu -200A可见异物检查专用伞棚灯,调节光源的光亮强度,配用照度计,将仪器的光强调节至1000 lx-1500 lx,将样品置于遮光板边缘处,手持容器颈部,轻轻反转以避免产生气泡,随后进行观察。
测试结果:
可见异物系指存在于注射剂、眼用液体制剂和无菌原料药中,在规定条件下目视可以观测到的不溶性物质,其尺寸大于50 μm。下表为《中国药典》0904章节中对于注射液无菌制剂中不溶性微粒数量的判定要求。
表三:注射用无菌制剂结果判定
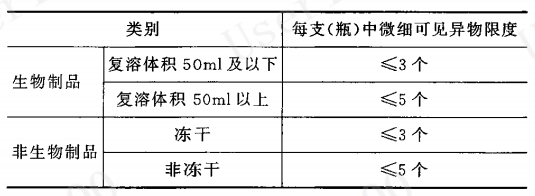
图3为不同样品在Lu-200A可见异物检查专用伞棚灯下的实物图,可以清晰地观察到样品溶液中存在可见异物,并且其中的可见异物数量超过药典中的规定标准,其中样品A中的可见异物Z多,这与该系列样品的不溶性微粒测试结果相一致。
图3. 不同样品在Lu-200A可见异物检查专用伞棚灯下的实物图

三、 检测总结果
经过对上述生物蛋白制剂微粒异物检测分析可以得出以下结论:该生物蛋白质剂经过澄清度检查、不溶性微粒检查以及可见异物检查之后,虽然该生物制剂的不溶性微粒检查结果已经达到了《中国药典》中相关章节的检测标准,但是其可见异物检查观察到的粒子数量已超过《中国药典》中的标准规范。
以上的测试结果表明HN-200A澄清度检查专用伞棚灯、YH-MIP-0103显微计数法不溶性微粒分析仪、Lu-200A可见异物检查专用伞棚灯均可对生物药用蛋白制剂中的微粒异物进行有效的检测,并且三项测试得到的测试结果具有很好的一致性,表明以上仪器均符合《中国药典》中相关检查的仪器要求。